(4分)现有可逆反应:mA(g)+nB(g) pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答:
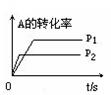
(1)左图中温度t1℃ t2℃(填“高于”或“低于”)
(2)该反应的正反应为 反应(填“吸热”或“放热”)
(3)右图中压强 p1 p2(填“>”、“<”、“=”)
(4)反应式中(m +n) (p +q)(填“>”、“<”、“=”)
相关知识点
(4分)现有可逆反应:mA(g)+nB(g) pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答:

(1)左图中温度t1℃ t2℃(填“高于”或“低于”)
(2)该反应的正反应为 反应(填“吸热”或“放热”)
(3)右图中压强 p1 p2(填“>”、“<”、“=”)
(4)反应式中(m +n) (p +q)(填“>”、“<”、“=”)