800K时将1mo A(g)和l molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+B(g)
molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+B(g)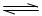 c(g)+D(g),在某条件下达到平衡时有2/3的A转化为D,求:
c(g)+D(g),在某条件下达到平衡时有2/3的A转化为D,求:
(1)该平衡混合物中D的体积分数;
(2)该温度下的平衡常数;
(3)B的转化率。
恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、 mol;
(本小题请给推算过程)
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
(8分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g) " △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H= kJ/mol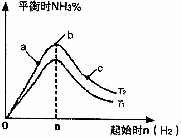
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
在10L密闭容器中,放入8.0gSO3在一定条件下反应:2SO3(g)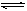 2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
在127℃和1.0×105Pa时,向某容器中放入18.4gN2O4使之发生反应N2O4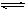 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
工业上有一反应2A(g)+B(g)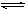 3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
(1)平衡时A和B的转化率。
(2)平衡时混合气体的平均分子量。
在一定温度下将100mLN2,H2混合气充入密闭恒压容器内,发生反应达到平衡时维持温度不变,测得混合气的密度是反应前密度的1.25倍,平均分子量为15.5。求平衡时N2的转化率;N2,H2两种气体开始时各为多少毫升?
把4 mol A和4 mol B混合放入容积为2L的密闭容器里,发生反应3A(g)+2B(g) x C(g)+2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.1 mol·L-1·s-1,同时生成2 mol D。试计算:(1)达到平衡状态时B的转化率;
x C(g)+2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.1 mol·L-1·s-1,同时生成2 mol D。试计算:(1)达到平衡状态时B的转化率;
(2)试算x的值;
(3)若温度和压强维持不变,当生成2 mol D时,此时容器内气体的体积是多少?
在一定条件下将物质的量相等的NO和O2混合发生如下反应:2NO+O2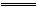 2NO2,2NO2
2NO2,2NO2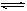 N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均相对分子质量。
N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均相对分子质量。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e- △H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g) △H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。

①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2molN2 |
3molH2 |
0molNH3 |
1.5molNH3 |
同种物质的体积分数相同 |
| 乙 |
amolN2 |
bmolH2 |
0molNH3 |
1.2molNH3 |
起始时乙容器中的压强是甲容器的____倍。
在一密闭容器中发生反应: 2A(g)+B(g) E(g)
E(g)
(1)写出该反应的平衡常数表达式___________ ____,已知升高温度时,v(正)>v(逆),此时K值__ __(填“变大”“变小”或“不变”);该反应的△H_____0(填“>”、“=”、“<”);
(2)将1.0mol A和1.0mol B混合后装入2L容器中发生反应,E的物质的量的变化如图所示。
①3分钟内E的平均反应速率为________ _________;
②求此温度下该反应的平衡常数K= (结果保留小数后1位);
③请在图中画出5分钟内A的物质的量变化的曲线;
(3)已知在如图所示的变化中,平衡常数K保持不变,则在5~7min内引起E的物质的量变化的原因可能是____________(填编号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量。
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 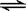 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?