广东省广州市七区联考高二化学下学期期末监测
一种有机物燃烧后产生CO2、H2O、SO2,则该化合物中可能不含有的元素是
| A.C | B.H | C.O | D.S |
(CH3CH2)2CHCH3的正确命名是( )
A 2-乙基丁烷 B 2-甲基戊烷 C 3-甲基戊烷 D 3-乙基丁烷
下列反应中,属于水解反应且使溶液显酸性的是
A.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
B.HCO3- CO32- + H+ CO32- + H+ |
C.S2- + H2O HS-+ OH- HS-+ OH- |
D.NH3 +H2O NH4+ +OH- NH4+ +OH- |
药物S-诱抗素的分子结构如图,该物质不含有的官能团是
| A.羧基 |
| B.羟基 |
| C.酯基 |
| D.碳碳双键 |
下列关于催化剂的说法正确的是
| A.使用催化剂可以增大正反应速率,减小逆反应速率 |
| B.使用催化剂可以使化学平衡向正反应方向移动 |
| C.使用催化剂可以降低反应的活化能 |
| D.使用催化剂可以改变反应的平衡常数 |
下列叙述正确的是
| A.某反应的焓变小于零,该反应一定能自发进行 |
| B.用湿润的pH试纸测稀盐酸溶液的pH为3.52 |
| C.草木灰(K2CO3)是钾肥,硫酸铵是氮肥,二者混合施用可以提高肥效 |
| D.原电池是将化学能转变为电能的装置 |
用石墨作电极,电解下列物质的水溶液,实质上与电解水一致的是
| A.NaOH | B.NaCl | C.CuSO4 | D.CuCl2 |
木糖醇可作口香糖中的甜味剂,可以防止龋齿,其结构简式为下图。下列有关木糖醇的说法不正确的是
| A.木糖醇是—种多元醇,但不属于糖类 |
| B.木糖醇具有还原性,能发生氧化反应 |
| C.木糖醇分子式为C5H10O5 |
| D.木糖醇易溶于水,一定条件下能与乙酸发生酯化反应 |
右图是某有机物的简易球棍模型,该物质只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是
A.分子式为C3H8NO2
B.在一定条件下,可以通过聚合反应,生成高分子化合物
C.不能和盐酸溶液反应
D.不能和NaHCO3溶液反应,生成CO2
有关下列事实中用勒夏特列原理不能解释的是
| A.实验室用排水法收集氯气时用饱和食盐水代替水以减少氯气的溶解 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.实验室保存硫酸亚铁溶液时加入几枚铁钉以防止试剂变质 |
| D.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率 |
图1和图2是A、B两种物质的核
磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出不可能属于图1和图2的两种物质是 

A.A是C3H6 ;B是C4H6 B.A是C2H6 ;B是C3H6
C.A是C2H6 ;B是C6H6(苯) D.A是C3H6;B是C2H6
表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度的关系式中正确的
| A.C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-) |
| B.C(Na+) = C(HCO3-) |
| C.C(Na+)+C(H+) = C(HCO3-)+2C(CO32-)+C(OH-) |
| D.C(Na+) = C(HCO3-)+C(CO32-)+C(H2CO3) |
设NA为阿伏加德罗常数,下列叙述中不正确的是
| A.1LpH=1的甲酸溶液中,H+数目为0.1 NA |
| B.标准状况下,3.36L乙醇中含有的分子数为0.15 NA |
| C.1 mol甲基(-CH3)所含电子数9NA |
| D.1L 1mol/L的FeCl3溶液所含的Fe3+数目为NA |
仔细观察右图,下列有关说法正确的是
| A.图中b区的直链烷烃在常温下呈液态 |
| B.直链烷烃的熔点随分子中碳原子的增加逐渐升高 |
| C.汽油的化学成份为C5~C12的碳氢化合物,分馏石油时,收集汽油的温度应 控制在200℃以下 |
| D.碳原子数相同的不同烷烃,其沸点都相同 |
完成以下实验:①
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、 (写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。
(18分)A和B在一定条件下可合成芳香族化合物E,G在标准状况下是气体,此情况下的密度为1.25g/L。各物质间相互转化关系如下所示:
请回答下列问题:
(1)G中的官能团是 (用化学式表示),D中的官能团名称是 ,F的结构简式为 。
(2)指出反应类型:① ,② ,③ 。
(3) 写出化学方程式:A→C ;
C与新制的氢氧化铜悬浊液反应: 。
(4)满足下列条件的B的同分异构体有 种。
①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基
(8分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g) " △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H= kJ/mol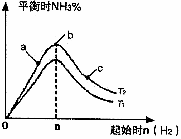
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
(12分)
Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-) (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+) ;
③若改加更多的KBr固体,则c(Ag+) ,c(Cl-) ;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是 ;
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
Ⅱ.最近有人制造了一种燃料电池使汽油氧化直接产生电流,其中一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- -50e-==8CO2 + 9H2O,,正极的电极反应式为 。固体电解质里O2-的移动方向是 ,向外电路释放电子的电极是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号