福建省厦门市高二下学期质量检测化学试题
废电池必须进行集中处理的主要原因是: ( )
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.防止电池中渗泄的电解液腐蚀其他物品 |
D.回收其中的石墨 电极 电极 |
2010年我国“两会…‘一号提案”锁定“低碳经济”,下列做法不符合“低碳经济”的是
( )
①禁止电动自行车上路;
②以煤等燃料作为主要生活燃料;
③鼓励私人购买和使用小汽车以代替公交车;
④利用太阳能、风能和氢能等新能源代替化石燃料
A.①②③ B .②④ C.①④ D.②③④
.②④ C.①④ D.②③④
在100 mL0.01 mol·L-1KCl溶液中,加入1 mL0.01 mol·L—1AgNO3溶液,下列说法正确的是(已知AgCl Ksp=1.8×10-10) ( )
A.有沉淀但不是AgCl B.无AgCl沉淀
c.有AgCl沉淀析出 D.无法确定
某学生的实验报告所列出的下列数据,合理的是 ( )
| A.用200 mL量筒量取7.1 mL稀盐酸 |
| B.用酸式滴定管量取某稀硫酸20.40 mL |
| C.用广泛pH试纸测得某溶液的pH为11.3 |
| D.用托盘天平精确称量某碳酸钠样品8.32 g |
下列各组离子在水溶液中能大量共存的是 ( )
| A.Na+、NH4+、:HCO3一、OH- |
| B.Fe3+、Zn2+、I-、SO42- |
| C.H+、K+、NO3-、SO42一 |
| D.Ca2+、Na+、NO3-、CO32- |
下列离子方程式书写正确的是 ( )
| A.硫酸铜溶液中加入过量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ | |
B.A1Cl3溶液中加过量的NaOH溶液:Al 3++3OH-=Al(OH)3↓ 3++3OH-=Al(OH)3↓ |
|
C.铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
D.碳酸钙与过量盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
某学生在一次课外活动中设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 ( )
| A.铂片端作阴极,发生氧化反应 |
| B.铅笔端作阴极,发生还原反应 |
| C.铅笔端有少量的氯气产生 |
| D.a点是正极,b点是负极 |
在室温下,一列等体积的酸和碱溶液混合后,pH一定大于7的是 ( )
| A.pH=3的HNO3与pH=11的KOH溶液 |
| B.pH=3的醋酸与pH=11的KOH溶液 |
| C.pH=3的硫酸与pH=11的NaOH溶液 |
| D.pH=3的盐酸与pH=11的氨水 |
一定温度下的恒容容器中,能确定可逆反应A(s)+2B(g) C(g)+D(g)已达平衡状态的是 ( )
C(g)+D(g)已达平衡状态的是 ( )
| A.单位时间内消耗n mol C,同时消耗2 n mol B |
| B.混合气体的压强不随时间变化而变化 |
| C.气体总物质的量不随时间变化而变化 |
D. |
实验室要保存下列试剂:①醋酸钠溶液②氧化钠溶液③硝酸钠④碳酸钠溶液⑤氯化铝溶液,其中不能盛放在带磨口玻 璃塞的试剂瓶中的是 ( )
璃塞的试剂瓶中的是 ( )
| A.①和③ | B.①和④ | C.①和④ | D.④和⑤ |
在密闭容器中,反应:CH4(g)+H2O (g)
(g) CO(g)+3H2(g)△H>0,达到平衡状态。下列叙述正确的是 ( )
CO(g)+3H2(g)△H>0,达到平衡状态。下列叙述正确的是 ( )
| A.增加甲烷的量,上式中△H增大 |
| B.增大水蒸气的量,可提高水蒸气的转化率 |
| C.升高温度,逆反应速率增大,正反应速率减少 |
| D.增大体系压强,该反应的化学平衡常数不变 |
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g) cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
| A.反应速率增大 | B.平衡向右移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
目前科学家已开发出一种新型燃料电池一固体氧化物电池,该电池用辛烷(C8H18)作燃料,电池中间部分的固体氧化物陶瓷可传递氧离子。下列说法正确的是 ( )
| A.电池工作时,氧气发生氧化反应 |
| B.电池负极的电极反应为:O2+2H2O+4e一=4OH— |
| C.电池负极的电极反应为:C8H18+25O2-一50e一=8CO2+9H2O |
| D.若消耗的O2为11.2 L(标准状况),则电池中有1 mol电子发生转移 |
在0.1 mol·L-1Na2CO3溶液中,下列关系正确的是 ( )
| A.c(Na+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+) |
| B.c(Na+)+c(H+)=c(HCO3一)+c(CO32-)+c(OH一) |
| C.c(Na+)>c(CO32一)>c(HCO3-)>c(H+)>c(OH一) |
| D.c(HCO3一)+2c(CO32一)+c(H2CO3)="0.1" mol·L-1 |
神舟7号的成功发射,说明我国的空间技术又向前迈进了一步。
(1)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g) △H="+67.7" 0.1 mol·L-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 0.1 mol·L-1;
0.1 mol·L-1;
则肼与二氧化氮反应的热化学方程式为:
(2)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2 O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为 ;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为
O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为 ;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为
下列反应在210℃时达 到平衡:
到平衡:
①PCl5(g) PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
②CO(g)+C12(g) COCl2(g) △H2<O K2=5×104 mol·L-1
COCl2(g) △H2<O K2=5×104 mol·L-1
③COCl2(g) CO(g)+Cl2(g) K3=?
CO(g)+Cl2(g) K3=?
④2SO2(g)+O2(g) 2SO3(g) △H4<0
2SO3(g) △H4<0
(1)反应③的平衡常数K3为  。
。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号,下同)。
A.降低反应①、②体系中Cl2浓度
B.反应①降低温度,反应②维持210℃
C.反应①、反应②同时升高温度
(3)欲使反应④向正方向移动,可采取的措施是
A.恒温下扩大容器体积 B.减少SO3的物质的量
C.恒压下升温
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为 (填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
c(CH3COO-)(填“>”、“=”或“<”)。
(3)常温下,已知某NH4Cl溶液中的c(NH4+)=c(Cl一),则该溶液的pH 7(填“>”、“=”或“<”)。
(4)如果将HCl和CH3COONa溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连。
(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有 ;②Y极的电极反应式为
(2)若要用电解方法精炼粗铜,则①电解液a选用 ;②Y电极反应式是 。(说明:杂质发生的电极反应不必写出)
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是 ;②X电极反应式是 。
某研究性学习小组为了研究醋酸的电离情况,进行了如下探究。
实验一 配制并标定醋酸溶液的浓度
用冰醋酸配制250 mol·L-1的醋酸溶液,再用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液。
(1)配制此醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为了标定所配制醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.04 |
20.00 |
18.80 |
19.96 |
则 该醋酸溶液的准确浓度为 。(保留四位有效数字)
该醋酸溶液的准确浓度为 。(保留四位有效数字)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1 ) ) |
0.001 |
0.01 |
0.02 |
0.1 |
0.2 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(4)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度将 。(填增大、减小或不变)
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验方案完成该实验,简述实验的方案: 。
800K时将1mo A(g)和l molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+B(g)
molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+B(g)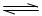 c(g)+D(g),在某条件下达到平衡时有2/3的A转化为D,求:
c(g)+D(g),在某条件下达到平衡时有2/3的A转化为D,求:
(1)该平衡混合物中D的体积分数;
(2)该温度下的平衡常数;
(3)B的转化率。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“ 原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H1 0(填“>”、
“=”或“<”)。
| 温度 |
25℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32一(aq) BaCO
BaCO 3(s)+SO42-(aq)(平衡常数K=0.042)
3(s)+SO42-(aq)(平衡常数K=0.042)
(1)现有0.20 mol BaSO4,每次用1.00 L 2.0 mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理 次。
(2)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是 。
A、B、C三种强电解质,它们在水中电离出的离子如右表所示:
右图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接 通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如右下图。据此回答下列问题:
通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如右下图。据此回答下列问题:

(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 ; (2)计算电极e上生成的气体在标准状态下的体积: ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应 ;
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么? ;
(5)若经过一段时间后,测得乙中c电极质量增加了16 g,要使丙恢复到原来状态的操作 。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应只生成CuSO3一种沉淀;
乙同学认为这两溶液能相互促进水解,生成气体和Cu(OH)2一种沉淀;
丙同学认为同时生成CuCO3和Cu(OH)2两种沉淀。(已知:CuCO3和Cu(OH)2均不带结晶水)
I(1)写出Na2CO3溶液水解的离 子方程式 ;
子方程式 ;
(2)在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为: (填操作名称)、干燥。
Ⅱ.请用右图所示装髓,选择必要的试剂,进行定性探究生成物的成分。
(1)各装置连接顺序为 → →
→ 。
。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列装置的连接,进行定量分析来测定其组成。
(1)装置c中碱石灰的作用是
(2)实验开始时和实验结束时都要通人处理过的过量空气,其作用分别是:
 。
。
(3)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3岛的质量分数为 ×100%。
 3C+4D反应中,相同条件下表示该反应速率最快的是 ( )
3C+4D反应中,相同条件下表示该反应速率最快的是 ( )



 的是 ( )
的是 ( )
 粤公网安备 44130202000953号
粤公网安备 44130202000953号