下列事实中,不能用勒夏特列原理来解释的是( )
| A.加入催化剂有利于氨的氧化反应 |
| B.氢硫酸中加碱有利于S2-离子的增多 |
| C.在100℃左右比在室温更有利于FeCl3的水解 |
| D.高压条件更有利于合成氨反应 |
 图中表示外界条件(t、p)的变化对下列可逆反应的影响:
图中表示外界条件(t、p)的变化对下列可逆反应的影响:
L(s)+G(g) 2R(g);△H>0,y 轴表示的是 ( )
2R(g);△H>0,y 轴表示的是 ( )
| A.平衡时,混合气中G的百分含量 | B.G的转化率 |
| C.平衡时,混合气中R的百分含量 | D.L的转化率 |
甲乙两容器中发生相同的反应: A(g) + 3B(g)  2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
A.体积:甲可能小于乙 B.C的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.A、C浓度比值c(A)/c(C):甲一定小于乙
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是( )
2AB(g)达到平衡状态的标志是( )
| A.单位时间内生成n molA2,同时生成n molAB |
| B.容器内混合气体的平均相对分子质量不随时间变化 |
| C.单位时间内生成2n molAB,同时生成n molB2 |
| D.单位时间内一个A-A键断裂,同时生成二个A-B键 |
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
2A(?)+ B(?)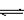 xC(g) ΔH<0
xC(g) ΔH<0
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是
A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
在t℃下,某反应达到平衡,平衡常数K=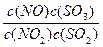 。恒容时,温度升高时NO浓度减小。下列说法正确的是
。恒容时,温度升高时NO浓度减小。下列说法正确的是
| A.该反应的焓变为正值 | B.若恒温下增大压强(缩小体积),则反应体系的颜色加深 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为NO+SO3 NO2+SO2 NO2+SO2 |
已知H2(g)+I2(g)  2HI(g)
2HI(g)  有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的
有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的 平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
一定条件下,可逆反应2A B+3C,在四种状态中处于平衡状态的是
B+3C,在四种状态中处于平衡状态的是
| |
正反应速率 |
逆反应速率 |
| A |
υA=2mol·(L·min) -1 |
υB=2mol·(L·min) -1 |
| B |
υA=2mol·(L·min) -1 |
υC=2mol·(L·min) -1 |
| C |
υA=1mol·(L·min) -1 |
υB=2mol·(L·min) -1 |
| D |
υA=1mol·(L·min) -1 |
υC=1.5mol·(L·min) -1 |
已知H2(g)+I2(g) ) 2HI(g)  有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol , 乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的
有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol , 乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的
措施是( )
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应: 4X(g)+3Y(g) 2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是 ( )
4X(g)+3Y(g) 2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是 ( )
| A.8 | B.6 | C.5 | D.3 |
不能用勒沙特列原理解释的是( )
| A.棕红色的NO2加压后颜色先变深后变浅 |
| B.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.加大压强更有利于合成氨 |
| D.常温下,将1mL pH=3的醋酸溶液加水稀释至100mL后,测得其pH<5 |
在右图所示的三个容积相同的容器①②③中均发生如下反应:
3A(g)+B(g)  2C(g) ;△H<0
2C(g) ;△H<0
下列说法正确的是
A.若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③>②>①
B.若维持温度不变,起始时②中投入3 mol A、1 mol B;③中投入3 mol A,1 mol B和2molC,则达到平衡时,两容器中B的转化率②=③
C.若起始温度相同,分别向三个容器中充入1 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量一定相同
D.若起始温度相同,分别向三个容器中充入3a mol A和a mol B,则达到平衡时各容器中A物质的转化率一定相同
下列反应中符合下图图象的是
A.N2(g) +3H2(g) 2NH3(g) ;△H=—Q1kJ·mol—1(Q1>0) 2NH3(g) ;△H=—Q1kJ·mol—1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g) ;△H=+Q2kJ·mol—1(Q2>0) 2SO2(g)+O2(g) ;△H=+Q2kJ·mol—1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H=—Q3kJ·mol—1(Q3>0) 4NO(g)+6H2O(g);△H=—Q3kJ·mol—1(Q3>0) |
D.H2(g) +CO(g) C(s)+H2O(g);△H=+Q4kJ·mol—1(Q4>0) C(s)+H2O(g);△H=+Q4kJ·mol—1(Q4>0) |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:H2(g)+Br2(g)  2HBr(g)
2HBr(g) 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应, 平衡时Br2(g)的转化率为b。a与b的关系是( )。
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应, 平衡时Br2(g)的转化率为b。a与b的关系是( )。
| A.a>b | B.a="b" | C.a<b | D.无法确定 |