甲乙两容器中发生相同的反应: A(g) + 3B(g) 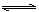 2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
A.体积:甲可能小于乙 B.C的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.A、C浓度比值c(A)/c(C):甲一定小于乙
甲乙两容器中发生相同的反应: A(g) + 3B(g) 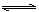 2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
A.体积:甲可能小于乙 B.C的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.A、C浓度比值c(A)/c(C):甲一定小于乙