对于平衡体系2SO2(g)+O2(g) 2SO3(g) △H<0。下列结论中正确的是( )
2SO3(g) △H<0。下列结论中正确的是( )
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1 |
| C.若从平衡体系中分离出SO2,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
下列描述违背化学原理的是 ( )
| A.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量低 |
B.反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大。 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大。 |
| C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D.电解饱和食盐水时,阳极的电极反应式为:2CL—2e-=Cl2↑ |
在一密闭容器中进行反应: 。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达平衡时可能存在的数据是 ( )
。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达平衡时可能存在的数据是 ( )
| A.SO2为0.4mol·L-1,O2为0.2mol·L-1 | B.SO3为0.25mol·L-1 |
| C.SO2、SO3均为0.15mol·L-1 | D.SO3为0.4mol·L-1 |
煤化工生产中常研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
则下列说法错误的是 ( )
| A.在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50% |
| B.上述正向反应是放热反应 |
| C.某温度下上述反应平衡时,恒容、升高温度,原化学平衡向逆反应方向移动 |
| D.在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小 |
一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体)  Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是:
Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是:
( )
| A.溶液中氢氧根离子浓度增大 | B.溶液中钡离子浓度减少 |
| C.溶液中钡离子数目减小 | D.pH减小 |
可逆反应在2A(g) + 3B(g)  3C(g)一定条件下,使一定量的A和B反应达到平衡状态时,下列说法正确的是( )
3C(g)一定条件下,使一定量的A和B反应达到平衡状态时,下列说法正确的是( )
| A.平衡混和物的体积是反应刚开始时的3/5 |
| B.平衡混和物中各物质的浓度比为2 :3 :3 |
| C.单位时间内若消耗了a mol A,必须同时也消耗了1.5 a mol 的C |
| D.平衡混和物中各物质的浓度相等 |
一定温度下,固定体积的容器中充入1molSO2和1molO2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法错误的是
A.体系中的总反应是:2SO2+ O2 2SO3 2SO3 |
| B.在反应过程中NO是催化剂 |
| C.NO参与反应历程,降低反应活化能,加快反应速率 |
| D.NO的引入可以增加SO2的平衡转化率 |
 是制备硫酸的重要反应。下列叙述正确的( )
是制备硫酸的重要反应。下列叙述正确的( )
A.催化剂 不改变该反应的逆反应速率 不改变该反应的逆反应速率 |
| B.增大反应体系的压强,反应速率一定增大 |
C.在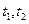 时刻, 时刻, 的分别是 的分别是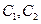 ,则时间间隔 ,则时间间隔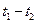 内, 内, 生成的平均速率为 生成的平均速率为 |
| D.该反应是放热反应,降低温度将缩短反应达到平衡时间 |
一定温度下,有可逆反应,

 ,
,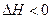 ,现将
,现将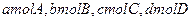 充入体积为V的某容器中,达平衡时各物质的浓度恰好相等,则升高一定温度后,反应达到新平衡时的化平衡常数可能为( )
充入体积为V的某容器中,达平衡时各物质的浓度恰好相等,则升高一定温度后,反应达到新平衡时的化平衡常数可能为( )
| A.1 | B.1.01 | C.0.90 | D.无法确定 |
一定条件下,等物质的量的N2和H2反应达平衡时,NH3的体积分数为40%,则下列叙述不正确的是( )
| A.N2的转化率为28.57% | B.H2的转化率为85.7% |
| C.N2的体积分数为20% | D.H2的体积分数为10% |
已达到平衡的下列可逆反应中,增大压强(缩小体积),体系的颜色不变深的是( )
A.2   |
B.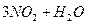   |
C.2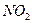  2NO+O2 2NO+O2 |
D.  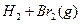 |
一定条件下某容器中发生反应:

 ,下列不能判断反应达到平衡的标志的是( )
,下列不能判断反应达到平衡的标志的是( )
| A.气体密度不变 | B. |
| C.压强不变 | D.反应速率不变 |
一定条件下,在N2+3H2 2NH3的化平衡体系中,N2、H2、NH3的浓度分别为
2NH3的化平衡体系中,N2、H2、NH3的浓度分别为
 ,若起始时NH3有最大浓度,则起始时N2的浓度为( )
,若起始时NH3有最大浓度,则起始时N2的浓度为( )
A.0  |
B.3.2 |
C. |
D.无法确定 |
将等物质的量的A和B混合于2L的密闭容器中,发生如下反应: ,经过5
,经过5 后测得D的浓度为
后测得D的浓度为 ,C的反应速率为
,C的反应速率为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
A.5 末,A的浓度为 末,A的浓度为 |
B.0-5 时,B的平均反应速率为 时,B的平均反应速率为 |
| C.B的起始物质的量为1.5mol |
| D.=2 |