将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:
2A(g)+3B(g) 2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:v(D)=0.25 mol/(L·min),则下列推断正确的是
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:v(D)=0.25 mol/(L·min),则下列推断正确的是
A.v(C)=0.2 mol/(L·min) B.z=3
C.B的转化率为25% D.C的体积分数约为28.6%
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0下列叙述正确的是
Z(g)+W(s) ΔH>0下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.升高温度,平衡逆向移动 |
| C.当容器中气体压强不变时,反应达到平衡 |
| D.平衡后加入X,上述反应的ΔH增大 |
NH3加热分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为
| A.80% | B.60% | C. 50% | D.40% |
如图曲线a表示放热反应X(g)+Y(g)⇌Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.升高温度 | B.加大X的投入量 |
| C.缩小体积 | D.减小N的投入量 |
在一定温度下的定容容器中,不能表明反应A(s)+2B(g) C(g)+D(g)已达到平衡状态的:
C(g)+D(g)已达到平衡状态的:
| A.混合气体的密度不变 | B.混合气体的压强不变 |
| C.混合气体的平均相对分子质量不变 | D.B的转化率不变 |
你认为不正确的是
| A.化学反应速率理念可指导怎样在一定时间内快出产品 |
| B.化学平衡理念可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.用速率理论和平衡理论都可提高化工生产的综合经济效益 |
对于可逆反应:C(s)+CO2(g)  2CO(g),在一定温度下其平衡常数为K。下列条件的变化中,能使K值发生变化的是
2CO(g),在一定温度下其平衡常数为K。下列条件的变化中,能使K值发生变化的是
| A.将C(s)的表面积增大 | B.增大体系的压强 |
| C.升高体系的温度 | D.使用合适的催化剂 |
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:
该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是
| A.CO过量 |
| B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 |
| D.CO与氧化铁的反应有一定限度 |
CO(g)+NO2(g) CO2(g)+NO(g)△H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是
CO2(g)+NO(g)△H<0,若其他条件不变,只改变下列条件,能使混合气体颜色变深的是
| A.降低温度 | B.使用催化剂 |
| C.增大CO的浓度 | D.增大压强 |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
下列不可以用勒夏特列原理解释的是
| A.冬天食物难以腐败 |
| B.用过量O2与SO2混合制SO3 |
| C.将盛NO2的瓶子放入冰水中,颜色变浅 |
| D.工业上制NH3时产用高压 |
下列关于化学平衡常数的说法正确的是
| A.化学平衡发生移动,平衡常数必发生变化 |
| B.平衡常数发生变化,化学平衡必发生移动 |
| C.改变浓度,平衡常数一定改变 |
| D.催化剂改变达到平衡的时间,必引起平衡常数的改变 |
如图为反应2A(g)=B(g)+C(g)的速率v(A)变化的图象,其中纵坐标可能是
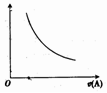
A.温度 B.压强 C.A的浓度 D.反应时间