乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。

(1)装置B发生反应的离子方程式为_______________________;B中可观察到的现象是铁粉逐渐溶解,_________________________。
(2)将B中生成的FeCl2溶液压入装置C的操作是______________________。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(3)FeCO3与乳酸[CH3CH(OH)COOH]反应的离子方程式为_________________________。
(4)反应后加入适量乳酸的作用是________________。
(5)从所得溶液中获得乳酸亚铁晶体所需的实验操作是______ _、过滤、洗涤、干燥。
(6)设计实验证明乳酸亚铁中含Fe2+ ____________________ _________。
硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式 。
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是 。
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式 。
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。已知它易溶于水,难溶于乙醇,加热易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
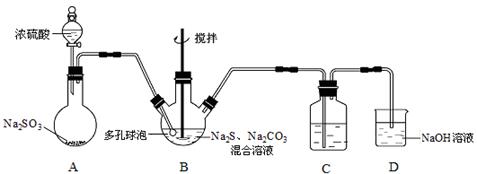
(1)装置A中发生反应的化学方程式是 。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为 ,生成的硫代硫酸钠粗品可用 洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是 ,表明SO2吸收效率低的实验现象是C中溶液 。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 (写出一条)。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为: (实验中供选用的试剂及仪器: CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管。提示:室温时CaCO3饱和溶液的pH=9.5)
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
② Na2S2O5晶体在空气中被氧化生成Na2SO4。

(1) 装置Ⅰ中产生气体的化学方程式为______________________________。
(2) 要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3) 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

(4) 检测Na2S2O5晶体在空气中已被氧化的实验方案是 ___________________。

(5)为了研究干燥的Cl2与干燥SO2反应及进行程度。用如图所示装置收集满干燥的Cl2,再通入干燥SO2,集气瓶中立即产生无色液体SO2Cl2,充分反应后,将液体和剩余气体分离。继续用NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 ,由此可知反应后剩余气必然存在 气体,综合实验信息,请写出干燥的SO2与Cl2反应的化学方程式 。
某校化学兴趣小组为研究Cl2的性质,设计如下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。

(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是 。
(2)装置Ⅱ的作用是 。
(3)实验过程中,装置IV中的实验现象为________________________;发生反应的化学方程式为 。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置 与 之间添加下图中的 装置(填序号),该装置的作用是_______________。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式 。
某同学预设计实验测定H2在通常状况下的摩尔体积,设计如下实验步骤:①连接如图所示装置,并检查装置的气密性
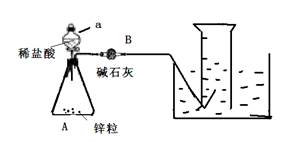
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为a g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为c g;
⑦处理数据等。
(1)写出A仪器中发生反应的化学方程式
(2)写出检查该装置气密性的方法
(3)A装置中仪器a的名称为
(4)若拆除B仪器(其他仪器不变), (填“会”或“不会”) 对本实验产生影响,理由是
(5)根据上述数据,计算在通常状况下,H2的摩尔体积Vm= (用含a、b、c等字母的代数式表示)
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。某化学兴趣小组对氯及其化合物进行探究。
(1)漂白精广泛用于饮用水消毒、医院环境消毒、游泳池消毒。资料查阅:随漂白精溶液酸性的增强,溶液会变为黄绿色。出现该现象的原因为_______________________(用离子方程式表示)。
(2)实验室可用氯气与金属铁反应制备无水三氯化铁.三氯化铁呈棕红色、易潮解,100℃左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
①仪器X的名称为__________________。
②制备三氯化铁的反应开始前,需排除装置中的空气,采取的方法是_________________。
③实验装置的连接顺序是a→___→___→___→___→___→___→___→___→___。
(3)设计实验证明FeC13的氧化性比I2强:__________________。
在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种装置代替[Ⅰ]的b~c部分,以求达到同样的目的。

试回答:
(1) 若用[Ⅰ]制取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时,如若发现c中液面不明显上升,你分析可能的原因是 ,检查的简单方法是 。
(2) 装置(Ⅰ)中b能防止多余气体逸散的原因是: 。
(3) 欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) 理由是: 。
[Ⅲ]是否可行(填“是”或“否”) 理由是: 。
Ⅰ.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。

| 气体 |
a |
b |
c |
d |
| C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
| Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
| NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
| NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
① 气体_____________,理由是____________________________ 。
② 气体_____________,理由是____________________________ 。
③ 气体_____________,理由是____________________________ 。
④ 气体_____________,理由是____________________________ 。
Ⅱ.用下图装置进行实验,将A逐滴加入B 中。

(1)若A为醋酸,B为石灰石,C为C6H5ONa溶液,则在 小试管中发生的现象是_______________,其中发生反应的化学方程式为_______________________。
(2)若B为生石灰,实验中观察到C溶液中先产生沉淀,而后沉淀逐渐溶解。当沉淀恰好溶解时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁上出现银镜。则A是_________,C是__________和乙醛的混合液,发生银镜反应的化学方程式为____________________________仪器D在实验中的作用是__________________。
实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。根据图中装置和现象请回答:

(1)按上图组装好实验装置后,首先进行的操作是 。
(2)丙中发生反应的化学方程式为 。
(3)丁中应选用的干燥剂 ,戊中的反应开始后断开电源,铂丝继续保持红热,说明该反应 (填“吸热”或“放热”)。
(4)戊中发生的主要反应的化学方程式
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
| |
苯甲酸 |
甲醇 |
苯甲酸甲酯 |
| 熔点/℃ |
122.4 |
-97 |
-12.3 |
| 沸点/℃ |
249 |
64.3 |
199.6 |
| 密度/g.cm-3 |
1.2659 |
0.792 |
1.0888 |
| 水溶性 |
微溶 |
互溶 |
不溶 |
实验一:制取苯甲酸甲酯:在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________。
(2)大试管Ⅰ中除了装有15g苯甲酸和一定量的甲醇和沸石外还需要加入一定量浓硫酸,浓硫酸的作用是 。
(3)实验室制取乙酸乙酯时,为了除去乙酸乙酯中混有的乙酸所用试剂为 。
实验二:提纯苯甲酸甲酯:该实验要先把图A中制备的苯甲酸甲酯水洗提纯,再利用图B装置进行蒸馏提纯
(4)水洗提纯时所进行的操作为(填操作名称) 。
(5)用图B装置进行蒸馏提纯时,当温度计显示 时,可用锥形瓶收集苯甲酸甲酯。
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)C装置的作用是 。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(用化学方程式表示) 。为避免此副反应的发生,可将装置作何改进 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 。
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: 。装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
| |
a |
b |
c |
d |
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是___________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式:_________________。
资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水。
b.SO2、Na2SO3、Na2CO3反应可生成Na2S2O3。某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究。实验制备装置如图所示(省略夹持装置):

回答问题:
(1)装置A中发生反应的化学方程式是__________________;
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是____________________;
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是________________;
(3)在装置C中生成Na2S2O3.
①完成反应方程式:___SO2+_____ Na2S+_____Na2CO3=_____Na2S2O3+ _____
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是_______________;
(4)完成对所得产品的检测的实验:
| 推测 |
操作和现象 |
结论 |
| 杂质中的正盐成分可能有:Na2S、Na2CO3、Na2SO4 及___________ |
①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液, 有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解, 并有刺激性气味的气体产生。 |
产品杂质中: 一定含有________ 可能含有________ 一定不含有_________ |
亚氯酸钠(NaClO2)是重要的漂白剂,探究小组开展如下实验,回答下列问题:
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是______________,如果撤去D中的冷水浴,可能导致产品中混有的杂质是 __________。
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为__________;装置D中反应生成NaClO2的化学方程式为__________。
(3)反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是______;检 验 该离子的方法是_______。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②_______;③用38℃~60℃热水洗涤;④_________得到成品。