毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2.2H2O的流程如下:

(1)写出“浸取”环节发生的主要反应的离子方程式:____ 。实验室用37%的盐配置15%的盐酸,除量筒外还需使用下列仪器中的__________。
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图

①滤渣I中含 (填化学式)。再加入NaOH调节pH =12.5可除去_____________(填离子符号)。
②加入H2C204应避免过量的原因是_____________。
(3)25℃,H2C204和HF两种酸的电离平衡常数如下:

①HC2O4-的电离平衡常数表达式Ka2=________。
②H2C2O4溶液和NaF溶液反应的离子方程式为__________
FeSO4.7H2O俗称“绿矾”,是一种蓝绿色晶体。某课外活动小组同学在实验室发现一瓶绿矾已部分变质,拟用该试剂为原料,重新制取FeSO4.7H2O晶体,并测定其纯度。
【查阅资料】
①绿矾化学性质常不稳定,在潮湿空气中逐渐氧化变质,久置的绿矾溶液逐渐变为黄色,并出现棕黄色浑浊;
②硫酸亚铁的溶解度随温度升高而增大。
【制备晶体】
①取一定量已变质的“绿矾”于烧杯中,加适量水,搅拌,得到棕黄色悬浊液。
②加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全变为浅绿色为止。
③趁热过滤,并用少量热水洗涤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,过滤出晶体,用少量冰水洗涤,再用滤纸吸干水分,最后放人广口瓶中密闭保存。
请回答下列问题:
(1)完成久置绿矾溶液在空气中变质反应的离子方程式:

(2)实验步骤②中加入稀硫酸的目的是_____________
(3)实验步骤③中趁热过滤目的是_____________
(4)实验中两次用到过滤操作,完成该操作的玻璃仪器有烧杯、 。
【测定纯度】
有同学认为,制备过程中可能有少量Fe2+被氧化为Fe3+,导致产品不纯。他们设计了如下方案测定产品的纯度。

请回答下列问题:
限选试剂:NaOH溶液、KSCN溶液、H2O2溶液、苯酚稀溶液、K3[Fe(CN)6]溶液、BaCl2溶液
(5)检验产品中是否含有Fe3+的无机试剂最好是:_____________。
(6)试剂X是:_____________。
(7)产品中FeSO4.7H2O(摩尔质量为278 g/mol)的含量为:_____________(用质量分数表示)。
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2·2H2O和CaO2的主要流程如下: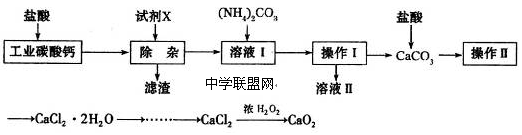
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___________。试剂X可以选择下列的________(填编号)。
| A.CaO | B.CaCO3 | C.NH3·H2O | D.Ba(OH)2 |
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有__________。
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是_______________。
(4)用下列装置测定工业碳酸钙的质量分数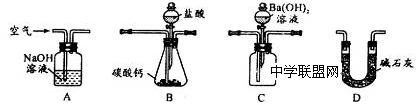
①检验装置B气密性良好的实验过程是__________________________。
②按A—B—C—D顺序连接,然后从A装置通入空气,目的是_______________;
③装置D的作用为______________________。
④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为__________________。
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g Al X溶液
X溶液 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7 g Al Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是
| A.b曲线表示的是向X溶液中加入NaOH溶液 |
| B.在O点时两方案中所得溶液浓度相等 |
| C.方案②中对应的O点HCl恰好反应完 |
| D.X溶液显酸性,Y溶液显碱性 |
KI在食品、医药领域有广泛用途。某科研小组利用碘废弃液(主要含I2、I-)制备KI,流程如下:

已知:I2+2S2O32-==S4O62-+2I-
(1)加入胆矾的作用 。
(2)为制得KI晶体粗产品,滤液后续操作步骤是 。
(3)用沉淀滴定法测定样品中KI含量的实验步骤如下:
A.称取3.000 g样品,溶解,配制成250 mL溶液
B.量取25.00 mL待测液于锥形瓶中;
C.用0.1000 mol•L-1AgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
D.重复b、c操作2~3次,平均消耗AgNO3标准溶液16.50 mL
①配制250mL样品溶液时,所需的仪器除烧杯、玻璃棒之外,还缺少的玻璃仪器是 。
②AgNO3标准溶液在使用之前通常要重新标定,原因是 ;本实验滴定过程中操作滴定管的图示正确的是______(填编号)。

③该样品中KI的质量百分数为 。
④下列因素会导致KI含量的测定结果偏高的是 。
A.配制样品溶液定容时仰视 B.锥形瓶未干燥
C.滴定管未用AgNO3标准溶液润洗 D.滴定终点时滴定管尖嘴中产生气泡
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
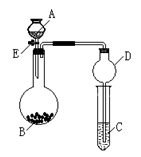
(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开 活塞E后,C中溶液颜色变化为 ,烧瓶中发生反应的化学方程式为 。
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是 ,固体的主要成分为(写化学式)_________________。
(3)利用上述装置可以验证SO2的性质, 若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有 溶液时可验证其具有漂白性;而C中盛有 溶液时可验证其具有还原性(各填一种物质名称)。
X、Y、Z、W为电子数相同的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答:

(1)实验室采用固件加热制取Z的化学方程式为: 。
(2)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。

①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(3)写出D装置中反应的化学方程式 。
(4)向含有ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解。已知 ,则被还原的HNO3的质量为 g。
,则被还原的HNO3的质量为 g。
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式 ;可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易吸水,溶于水后与水反应生成碳酸氢铵和一水合氨:NH2COONH4+2H2O NH4HCO3+NH3·H2O。可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的方程式:2NH3(g)+CO2(g)
NH4HCO3+NH3·H2O。可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的方程式:2NH3(g)+CO2(g) NH2COONH4(s)ΔH<0。
NH2COONH4(s)ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因 。
液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。 为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。

浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
(用如下装置可以完成一系列实验(图中夹持装置已略去)。

请回答下列问题:
Ⅰ.若在装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中所设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
④ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘 水混合液 |
氢硫酸 |
| 现象 |
a__________ |
b__________ |
褪色 |
浅黄色 |
| 体现SO2的性质 |
c__________ |
d__________ |
e__________ |
f__________ |
Ⅱ.若在装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)P中所盛试剂为__________________。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式__________________;①处包有的某固体物质可能是_____________。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到的现象为__________________。
(4)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:_______________。
(5)Ⅰ. Ⅱ两实验中尾气均可采用_________溶液吸收。(填化学式)
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为______________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的__________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为____________,试写出X的化学式_______________________。
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是_______________________。
②样品中氨的质量分数表达式为_____________________。
三氯化硼(BCl3)是一种重要的化工原料,可用于制取乙硼烷(B2H6),也可做有机合成的催化剂。某兴趣小组拟选用下列装置制备BCl3。
已知:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl 2BCl3↑+3H2↑③硼与铝的性质相似,也能与氢氧化钠溶液反应
2BCl3↑+3H2↑③硼与铝的性质相似,也能与氢氧化钠溶液反应

请回答下列问题:
(1)装置A中发生反应的离子方程式为 。
(2)按气流方向连接各装置的连接顺序为A→ →F(装置可重复使用),实验时应先点燃 处酒精灯(填“A” 或“B”)。
(3)装置E的两个作用是 、 。实验中若不用装置C,可能产生的危险是 。
(4)装置D的作用是 。
(5)BCl3遇水产生大量的白雾,同时生成硼酸(H3BO3),其反应的化学方程式为__________。
(6)设计实验方案验证所得的产品中是否含有硼粉: 。
某化学实验小组利用图所有仪器连接而成制备氮化镁,并探究其实验式。

(1)装置A中反应的化学方程式为__________________________。
(2)按气流方向的连接顺序是(填入仪器接口字母编号):a→( )( )→( )( )→( )( ) →( ) ( ) →j。
(3)装置E的作用是___________________。
(4)能否将C与D的位置对调并说明理由________________________。
(5)反应过程中,装置F中的末端导管必须始终插入水中,目的是______________________。
(6)请用化学方法确定是否有氮化镁生成,写出实验操作及现象_____________________。
(7)数据记录如下:
| 空硬质玻璃管质量 |
硬质玻璃管与镁的质量 |
硬质玻璃管与产物的质量 |
| 142.312g |
142.480g |
142.550g |
①计算得到实验式MgxN2,其中x=_________________;
②若没有装置D,请比较x与3的大小,并给出判断依据__________________。
Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
①把甲酸(HCOOH)溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如图所示
(1)A装置中的分液漏斗改为______(仪器名称)更合适,D中盛放的试剂为_______________。
(2)B装置的作用为___________________________;
(3)C装置的主要仪器名称为________,仪器内发生的化学反应方程式为____________________。
(4)分离C装置中产品时就选用下列装置______(填甲、乙、丙、丁,下同),回收乙醇的装置为_____。
(5)Na2S2O4在碱性环境中除去废水中的CrO42-及+4价S的化合物,反应的离子方程式为_________。
非金属元素及其化合物在工农业生产中应用非常广泛。请回答以下问题:
I.氯及其化合物
ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛,某兴趣小组通过如下图所示,对其制备、吸收、释放和应用进行了研究。

(1)A中发生反应的化学方程式: 。
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
II.硫及其化合物:
(1)选择以下装置,通过实验现象依次完成以下验证:SO2具有酸性、氧化性、还原性、漂白性。其仪器的连接顺序为 。

(2)利用下图装置能证明SO2不与BaCl2溶液反应,通入X气体可排除干扰达到实验目的是

A CO2 B NH3 C O3 D N2 E NO2
C发生的离子方程式 。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

按上述方案实验,当消耗标准I2溶液25.00 mL时,滴定完毕,滴定终点的标志 ,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。