关于下列各装置图的叙述中,正确的是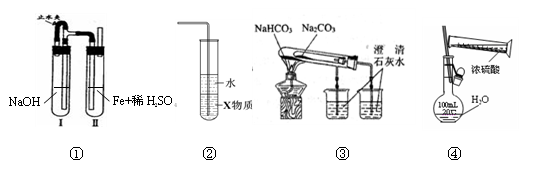
| A.用装置①可制备氢氧化亚铁并长时间观察其颜色 |
| B.装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸 |
| C.装置③验证Na2CO3和NaHCO3两种固体的热稳定性 |
| D.通过④的方法配制一定浓度的稀硫酸溶液 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
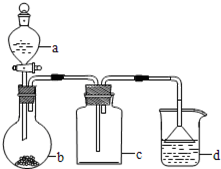
| 选项 |
a中的物质 |
b中的物质 |
c中的物质 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是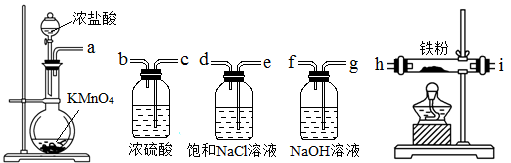
| A.a-e-d-c-b-h-i-g | B.a-d-e-c-b-h-i-g |
| C.a-e-d-h-i-g-f-c | D.a-b-c-d-e-f-g-h |
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
| A.a-b-c-d-e-f-g-h | B.a-c-b-d-e-h-i-f |
| C.a-d-e-c-b-h-i-g | D.a-e-d-c-b-h-i-g |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g Al X溶液
X溶液 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7 g Al Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是
| A.b曲线表示的是向X溶液中加入NaOH溶液 |
| B.在O点时两方案中所得溶液浓度相等 |
| C.方案②中对应的O点HCl恰好反应完 |
| D.X溶液显酸性,Y溶液显碱性 |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程:

下列说法不正确的是 ( )
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )

则下列叙述错误的是
| A.A气体是NH3,B气体是CO2 |
| B.把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片 |
| C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
| A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O |
| B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用 |
| C.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大 |
| D.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾 |
下列实验操作正确且能达到相应实验目的的是
| |
实验目的 |
实验操作 |
| A |
称取2.0gNaOH固体 |
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B |
制备Fe(OH)3胶体 |
向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C |
检验溶液中是否含有SO42- |
取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D |
萃取碘水中的碘 |
将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol |
| D.Y可能是葡萄糖 |
汞(熔点-39℃,沸点356℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。
下列分析错误的是
| A.洗涤粗汞可用5%的盐酸代替5%的硝酸 |
| B.辰砂与氧化钙加热反应时,CaSO4为氧化产物 |
C.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: |
| D.减压蒸馏的目的是降低汞的沸点,提高分离效率 |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4·7H2O),设计了如下流程,下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
| D.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O =NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.CO2的结构式为O=C=O,其中碳氧原子均满足8电子稳定结构 |
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用 +NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图。
饱和食盐水溶液
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |