已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
| |
溶解性 |
沸点(℃) |
密度(g/mL) |
| 乙醇 |
与水互溶 |
78.5 |
0.8 |
| 溴乙烷 |
难溶于水 |
38.4 |
1.4 |
某研究性学习小组的同学将乙醇、80%的硫酸、NaBr固体按一定比例混合后(总体积约140 mL)置于图1的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略)。

(1)①仪器A的名称是: ;
②容器B的容积是: ;
a.150 mL b.200 mL c.250 mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是 。
(3) HBr与乙醇反应生成目标产物的化学方程式 。
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取) ,然后再进行 操作即可。
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的 (从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从 口(填a或b)进入。
(6)若实验中使用的无水乙醇的体积是46 mL,蒸馏后得到的纯溴乙烷的体积是50 rnL,则溴乙烷的产率为 %。
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)“碱溶”时,粉煤灰发生反应的化学方程式为_____________________________
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为______________________________
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是__________________________
(4)“氧化”时应控制温度不超过57 ℃,其原因是_____________________________
(5)“氧化”时若用MnO2代替H2O2,发生反应的离子方程式是____________________
某学校化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c、d表示止水夹)。请按要求回答下列问题:
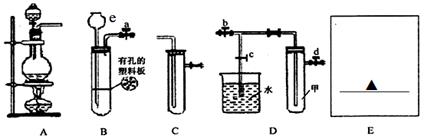
(1)用浓盐酸和MnO2加热反应制取氯气时,需选用上述装置(填字母,除杂和干燥装置略) 和C;还需补充装置E,并在上方方框内画出装置简图,并标注其所盛药品的名称。
(2)用稀盐酸和大理石常温下反应制备CO2时选装置B,B中仪器e的名称为 ,反应的离子方程式为 。
(3) 欲用D装置验证NO2是否能与水(滴有紫色石蕊试液)反应,其操作步骤为:①打开止水夹b、d,关闭止水夹c,并由b处通入一段时间的NO2到甲中充满红棕色气体;②关闭止水夹b、d,同时打开止水夹c,③然后 (写具体操作),观察到的现象有 。
为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序为:装置②→ ;
(2)装置②中主要玻璃仪器的名称 、 、 ;
(3)实验室制备Cl2的离子方程式为____________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入 试纸。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到 的现象,则证明制Cl2时有HCl挥发出来
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
| 物质 |
水 |
乙醇 |
乳酸 |
苯 |
乳酸乙酯 |
| 沸点/℃ |
100 |
78.4 |
122 |
80.10 |
154 |
②乳酸乙酯易溶于苯、乙醇;
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下: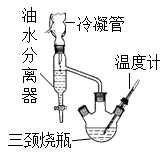
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石……;装上油水分离器和冷凝管,缓慢加热回流至反应完全。
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏。
(1)第一步操作中,还缺少的试剂是________;加入苯的目的是________;实验过程中,酯化反应进行完全的标志是____________。
(2)第二步中证明“水洗”已经完成的实验方案是__________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有____________个峰。
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),完成下列问题。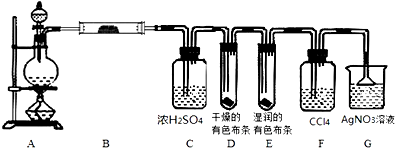
(1)用 MnO2和浓盐酸混合共热制得氯气的化学方程式是__________________;
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积在标准状况下总是小于1.12L的原因是__________________;
(3)①装置B的作用是__________________;
②装置D和E出现的不同现象说明的问题是__________________;
③装置F的作用是__________________;
④装置G中发生反应的化学方程式为__________________。
某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用。他们进行了两组实验,过程如下:
过程Ⅰ:
过程Ⅱ:
(1)废Cu粉中一定含有的杂质是___________________(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:
①_______________________________________;
③_______________________________________;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)=_________,m(Cu)= _________;
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
| A.a-b-c-d-e-f-g-h | B.a-c-b-d-e-h-i-f |
| C.a-d-e-c-b-h-i-g | D.a-e-d-c-b-h-i-g |
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。
某化学研究小组采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2→Na2S2O5

(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,需要用到的玻璃仪器有 。
装置III用于处理尾气,可选用的合理装置(夹持仪器已略去)为 (填序号)。

现将0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图。

(3)写出Na2S2O5溶解于水的化学方程式 ;
当溶液pH小于1后,溶液中H2SO3的浓度减小,其原因可能是 。
(4)葡萄酒常用Na2S2O5做抗氧化剂。1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。 用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
已知孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、SiO2。现以孔雀石为原料制备CuSO4·5H2O。
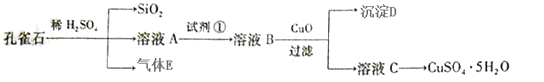
(1)实验步骤中试剂①最佳选择 (填代号);
a.H2O2 b.Cl2 c.KMnO4 d.HNO3
请写出其对应的离子方程式 。
(2)溶液B中加入CuO作用是 。
(3)由溶液C获得CuSO4·5H2O晶体,需要经___________、____________和过滤。
(4)25 ℃,Fe(OH)3的Ksp=1×10-38,若要将溶液中的Fe3+沉淀完全,必需调节溶液pH> 。
(5)实验室用惰性电极电解500ml的CuSO4溶液一段时间后,撤去电源,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,则电解过程中转移电子的物质的量为__________mol,原CuSO4溶液的物质的量浓度为________mol·L-1。
湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。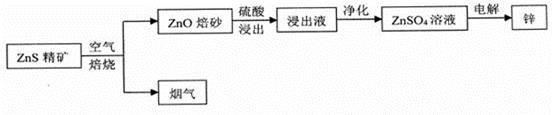
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________ 。
(2)浸出液以硫酸锌为主,还含有Fe 3+、Fe 2+、A1 3+、Cu 2+、Cd 2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
① 在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为_________________。
② 将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为__________(填字母)
| A.NaOH | B.NH3·H2O | C.ZnOH | D.H2SO4 |
③ 用Zn除去Cu2+和Cd2+
④ 用Ag2SO4除去Cl一,发生的离子方程式为,__________________。
(3)用两支惰性电极插入500 mL硫酸锌溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),锌在_________极析出,其质量为_________ mg。
工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁(氯化铁遇水能反应);向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
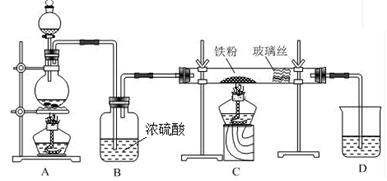
回答下列问题:
(1)检验该装置气密性的方法 。
(2) 制取无水氯化铁的实验中,A中反应的化学方程式为:
MnO2+4HCl(浓) 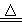 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
该反应的氧化剂为 ,氧化产物为 。
生成标况下11.2L Cl2时,转移的电子数为 。
(3)制取无水氯化亚铁的实验中,装置A用来制取 。
(4)该装置制取氯化铁时,存在两点明显缺陷,分别是 ;
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl是白色固体,难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以硫化铜精矿为原料生产CuCl的工艺过程如下:
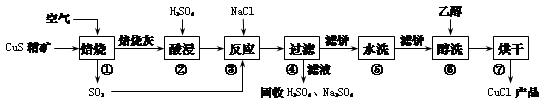
回答下列问题:
(1)CuS精矿经250 ℃低温焙烧后生成CuO,步骤②中主要反应的离子方程式是 。
(2)步骤③先加NaCl、通入SO2时无沉淀,加水稀释就产生大量白色沉淀,其原因是 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______(写名称);步骤⑥醇洗的作用是 。
(4)已知25℃,101 kPa时:S(s)+O2(g)==SO2(g) ∆H=-296.8 kJ/mol
2Cu(s)+O2(g)==2CuO(s) ∆H=-314.6 kJ/mol
Cu(s)+S(s)==CuS(s) ∆H=-53.1 kJ/mol
步骤①中CuS与O2反应的热化学方程式是 。
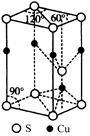
(5)CuS晶胞结构如图所示,其中含有硫原子的数目是 。
(6)假设上述①~③步反应完全转化,④~⑦步操作共损失产品3.5%,反应生成的硫酸全部被循环利用,则生产100 kg 96.5%的CuCl(Mr=99.0)产品,除循环利用之外,需要处理的尾气中含SO2 m3(标准状况)。
焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶。其性质活泼,具有强还原性,在食品加工中作防腐剂、漂白剂、疏松剂。某实验小组拟采用如图1装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式 为 .如果想控制反应速度,如图2中可选用的发生装置是 (填写字母).
(2)工业上为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) 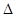 H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
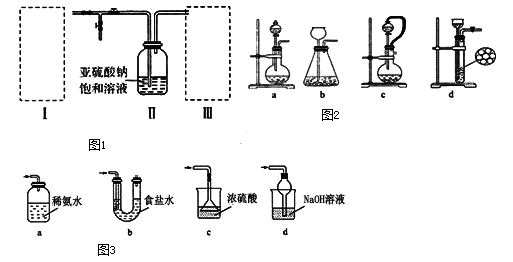
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)装置Ⅱ中发生反应的化学方程式为:2 NaHSO3=Na2S2O5+ H2O当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是 ;某同学需要420mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为 ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是 .
(5)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为 (填序号).
(6)工业制备焦亚硫酸钠(Na2S2O5)的过程如图:
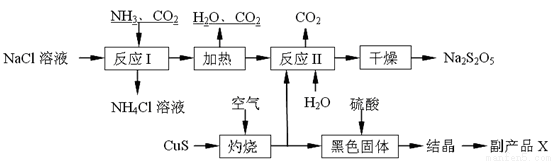
已知:反应Ⅱ包含2NaHSO3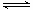 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
①实验室制取氨气的化学方程式: 。
②“灼烧”时发生反应的化学方程式: 。
③已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
④副产品X的化学式是: ;可循环利用的物质是:__________________。
⑤为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。