焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
② Na2S2O5晶体在空气中被氧化生成Na2SO4。

(1) 装置Ⅰ中产生气体的化学方程式为______________________________。
(2) 要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3) 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

(4) 检测Na2S2O5晶体在空气中已被氧化的实验方案是 ___________________。

(5)为了研究干燥的Cl2与干燥SO2反应及进行程度。用如图所示装置收集满干燥的Cl2,再通入干燥SO2,集气瓶中立即产生无色液体SO2Cl2,充分反应后,将液体和剩余气体分离。继续用NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 ,由此可知反应后剩余气必然存在 气体,综合实验信息,请写出干燥的SO2与Cl2反应的化学方程式 。


 TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下: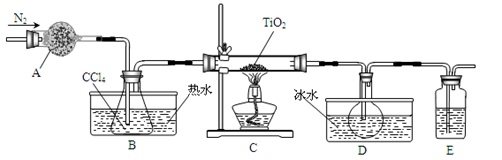
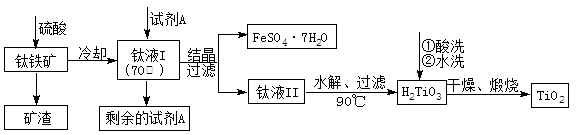
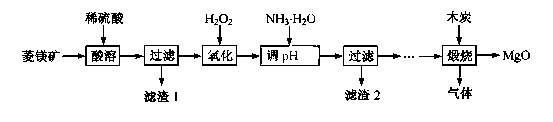


 10-12,当溶液pH=6时(填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时(填“有”或“没有”)Mg(OH)2沉淀析出。 粤公网安备 44130202000953号
粤公网安备 44130202000953号