下列有关实验的叙述中,合理的是
①用pH试纸测得某新制氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
| A.②④⑥ | B.②③⑥ | C.①②④ | D.②③④⑤⑥ |
下列说法中,正确的是
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的水溶液中不存在分子 |
| C.进行中和滴定时,锥形瓶不能用所盛溶液润洗 |
| D.不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
V mL Al2(SO4)3溶液中含Al3+a g,取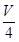 mL溶液稀释到4 V mL,则稀释后该溶液中SO42-的物质的量浓度是( )
mL溶液稀释到4 V mL,则稀释后该溶液中SO42-的物质的量浓度是( )
A. mol·L-1 mol·L-1 |
B.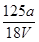 mol·L-1 mol·L-1 |
C.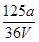 mol·L-1 mol·L-1 |
D.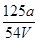 mol·L-1 mol·L-1 |
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
化学知识在生活中有重要意义,下列说法不正确的是
| A.草木灰(含有K2CO3)水溶液可以用于洗涤油污 |
| B.乙醇、乙酸和甲醛广泛应用于食品加工 |
| C.捕获排放的CO2能降低地球的温室效应 |
| D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
室温下,已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH-)=1×10-3mol·L-1的碱溶液等体积混合后溶液呈酸性,其原因可能是:
| A.等浓度的强酸和弱碱溶液反应 | B.生成了一种强酸弱碱盐 |
| C.浓的强酸和稀的强碱溶液反应 | D.浓的弱酸和稀的强碱溶液反应 |
0.1mol·L-1CH3COOH溶液中加水或加入少量CH3COONa晶体时,都会引起的变化的是:
| A.溶液的pH增大 | B.CH3COOH的电离程度变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
下列说法正确的是( )
| A.将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 |
| B.如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 |
| C.强电解质溶液的导电能力一定比弱电解质溶液强 |
| D.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需NaOH和醋酸所需NaOH相等 |
在下列溶液中Cl-离子的物质的量浓度最大的是
| A.0.5L 0.1mol/L的NaCl溶液 | B.100mL 0.2mol/L的MgCl2溶液 |
| C.1L 0.2mol/L的AlCl3溶液 | D.1L 0.3mol/L盐酸溶液 |
下列表示反应中电子转移的方向和数目正确的是
| A.MnO2+4HClM失去2e-nCl2+C得到2e-l2↑+2H2O |
| B.3S+6KOH===K2S失去4e-O3+2K2S得到2e-×2+3H2O |
| C.KClO3+6HCl===KCl得到6e-+3C失去6e-l2↑+3H2O |
| D.2KClO12e-3MnO2△2KCl+3O2↑ |
常温下 mol/L CH3COOH稀溶液和
mol/L CH3COOH稀溶液和 mol/L KOH稀溶液等体积混合,下列判断一定错误的是( )
mol/L KOH稀溶液等体积混合,下列判断一定错误的是( )
A.若 , , |
B.若 , , |
C. , , |
D.若 , , |
下列物质是电解质的是 ( )
| A.硫酸溶液 | B.酒精 | C.食盐 | D.铜 |
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: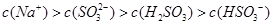 |
B.已知NaHSO3溶液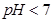 ,该溶液中: ,该溶液中: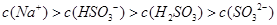 |
C.当吸收液呈中性时: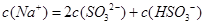 |
D.当吸收液呈酸性时: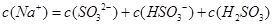 |
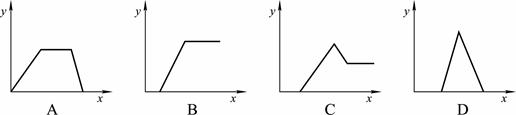
在HNO3、Al(NO3)3和Mg(NO3)2的混合溶液中逐滴加入NaOH溶液,则消耗NaOH溶液的体积(x轴)与生成沉淀(y轴)之间的关系表示正确的是