[陕西]2011-2012学年陕西省岐山县高二上学期期末质量检测理科化学试卷
下列过程一定释放能量的是
| A.化合反应 | B.分解反应 | C.原子组成分子 | D.分子拆成原子 |
下列各项与反应热的大、小无关的是
| A.反应物和生成物的状态 | B.反应物量的多少 |
| C.反应物的性质 | D.反应热的单位 |
下图为某反应的焓变示意图,下列有关该反应的说法中正确的是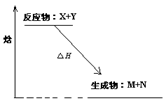
| A.△H>0 |
| B.X能量一定高于M |
| C.该反应为放热反应 |
| D.该反应一定不必加热就可以发生 |
某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是
| A.铁 | B.铜 | C.铝 | D.镁 |
下列各组物质的燃烧热相等的是
| A.碳和一氧化碳 | B.1 g碳和2 mol碳 |
| C.淀粉和纤维素 | D.3 mol乙炔(C2H2)和1 mol苯(C6H6) |
90 ℃时水的离子积KW=3.8×10-13,该温度时纯水的pH是
| A.等于7 | B.小于7 | C.大于7 | D.无法确定 |
关于如图所示装置的叙述,正确的是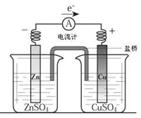
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-26,则下列各组离子在该溶液中一定可以大量共存的是
| A.K+、Na+、AlO2-、Cl- | B.Na+、Cl-、SO42-、HCO3- |
| C.NH4+、Fe3+、NO3-、SO42- | D.Ba2+、Na+、Cl-、NO3- |
下列离子方程式不正确的是
| A.氯化铁溶于水:Fe3++3H2O=Fe(OH)3+3H+ |
| B.NaOH溶液与盐酸反应:H++OH-=H2O |
| C.Cl2气通入烧碱溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
| D.Na投入大量水中:2Na+2H2O=2Na++2OH-+H2↑ |
下列说法中正确的是
| A.能够使甲基橙呈现黄色的溶液一定是碱性溶液 |
| B.凡需加热的反应一定是吸热反应 |
| C.水解反应是放热反应 |
| D.绝对不溶解的物质是不存在的 |
25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者小于后者 |
| D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
| A.0.1s | B.2.5s | C.5s | D.10s |
下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是 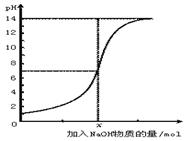
| A.原来盐酸的物质的量浓度为1 mol·L-1 |
| B.原来盐酸的物质的量浓度为0.1 mol·L-1 |
| C.x处为含NaOH0.1 mol的溶液 |
| D.x处为含NaOH0.001 mol的溶液 |
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
下银锌蓄电池的电极反应为:Zn + 2 OHˉ— 2eˉ= ZnO + H2O,
Ag2O + H2O + 2 eˉ=" 2Ag" + 2OHˉ。据此判断,氧化银是
| A.正极,并被还原 | B.负极,并被氧化 |
| C.正极,并被氧化 | D.负极,并被还原 |
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题: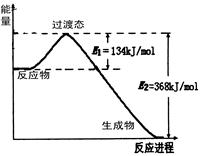
右图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
根据下列要求写出有关反应式:
(1)钢铁发生吸氧腐蚀时,正极反应式: ;
(2)用石墨作电极电解饱和食盐水的总反应: ;
(3)将石墨接负极,铜板接正极,当通以直流电时,电解硫酸铜溶液,发生氧化反应的电极反应式: ;
(4)向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,离子反应方程式: ;
(5)蒸干AlCl3溶液,并灼烧。涉及到的化学反应方程式: 。
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2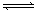 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
| 实验序号 |
温度0C |
初始CCl4浓度mol/L |
初始H2浓度mol/L |
CCl4的平衡转化率 |
| 1 |
110 |
0.8 |
1.2 |
A |
| 2 |
110 |
1 |
1 |
50% |
| 3 |
120 |
1 |
1 |
B |
(1)1100C时平衡常数:
(2)实验1中,CCl4的转化率A为:
(3)实验2中,10小时后达到平衡,H2的平均反应速率为: 。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向 反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值
①等于50% ②大于50% ③小于50% ④无法判断
某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂。
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的关系: 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号