酸碱完全中和时
| A.酸和碱的物质的量一定相等 |
B.酸所提供的H+与碱提供的 的物质的量相等 的物质的量相等 |
| C.酸和碱的物质的量浓度相等 |
| D.溶液一定呈中性 |
某温度下,分别在溶液中达到沉淀溶解平衡后,改变溶液
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是

| A. |
|
| B. |
加适量
|
| C. |
|
| D. |
|
下列说法中,正确的是( )
| A.在溶液中,H+、NO3-、Fe2+、Na+一定不能大量共存 |
| B.化学反应过程中,一定有物质的变化,不一定有能量的变化 |
| C.电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+ |
| D.向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 |
体积相同的NaCl、MgCl2、AlCl3溶液,完全沉淀其中的Cl-,需消耗等物质的量的AgNO3,则这三种溶液的物质的量浓度之比为( )
| A.3︰2︰1 | B.1︰2︰3 | C.6︰3︰2 | D.2︰3︰6 |
下列溶液中c(Cl-)与50 mL 1mol/L 的AlCl3溶液中氯离子浓度相等的是
| A.150 mL 1mol/L NaCl溶液 | B.75 mL 2mol/L NH4Cl溶液 |
| C.75 mL 1mol/L FeCl3溶液 | D.150 mL 2mol/L MgCl2溶液 |
重金属离子有毒。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要的有毒离子为Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( )
A.Cu2+和 |
B.Cu2+和Cl- | C.K+和 |
D.Ag+和 |
下列对化学反应的表示正确的是( )
A.用铜作电极电解硫酸铜溶液的离子方程式:2Cu2++2H2O 4H++2Cu+O2↑ 4H++2Cu+O2↑ |
| B.含氢氧化钠20.0 g的稀溶液与足量盐酸反应放出28.7 kJ的热量,热化学方程式:NaOH(aq)+ HCl(aq)====NaCl(aq)+H2O(l)ΔH="-28.7" kJ·mol-1 |
C.碳酸氢钙溶液中加入过量饱和氢氧化钙溶液的离子方程式:Ca2++ +OH-====CaCO3↓+H2O +OH-====CaCO3↓+H2O |
D.稀硝酸与过量铁粉反应的离子方程式:3Fe+8H++2 ====3Fe3++2NO↑+4H2O ====3Fe3++2NO↑+4H2O |
酸碱完全中和时
| A.酸和碱的物质的量一定相等 |
B.酸所提供的H+与碱提供的 的物质的量相等 的物质的量相等 |
| C.酸和碱的物质的量浓度相等 |
| D.溶液一定呈中性 |
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O====HBr+HIO。下列有关IBr的叙述不正确的是( )
| A.在很多反应中IBr是强氧化剂 |
| B.IBr与水反应时既作氧化剂,又作还原剂 |
| C.IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D.IBr与NaOH溶液反应时,生成NaBr和NaIO |
在如下图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )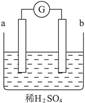
| A.碳棒上有气体放出,pH变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |
在0.2mol/L的CH3COOH溶液中分别加入下列物质后,有关判断正确的是
| A.适当升高温度,CH3COOH的电离程度减小 |
| B.加少量NaOH固体,CH3COOH 的电离平衡向正方向移动 |
| C.加少量0.1mol/L的HCl溶液,溶液中c(H+)增大平衡向正方向移动 |
| D.加少量CH3COONa固体,CH3COOH 的电离平衡平衡向正方向移动 |
标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为( )
NaHSO4是一种酸式盐。
(1)NaHSO4晶体熔化时的电离方程式为 。
(2)0.1mol·L-1的NaHSO4溶液的pH= 。
(3)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 。
(4)2mol·L-1NaHSO4与1mol·L-1Ba(OH)2溶液等体积混合,反应的离子方程式为______________。若在反应的溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为 。