某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为A→B→ (填字母)。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是 。
②在配制硫酸亚铁溶液时,需加入铁粉的理由是 。
Ⅱ.标定FeSO4溶液的浓度
(1)用滴定管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴定至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为 ,据此可测得FeSO4溶液的物质的量浓度为 mol·L-1。
(2)滴定时选用 (A.石蕊B.酚酞C.不用指示剂,填字母)为指示剂,理由是 。
(2014届江苏省高三百校联合调研测试(一)化学试卷)
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
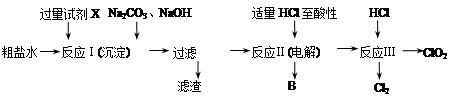
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度 (mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从第①组情况分析,HA是强酸还是弱酸 。该组所得混合溶液中由水电离出的c(OH-) = mol·L-1。
(2)第②组情况表明,c 0.2(选填“大于”、“小于”或“等于”)。该混合液中离子浓度c(A-)与c(Na+)的大小关系是 。
(3)从第③组实验结果分析,说明此时HA的电离程度 NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中各离子浓度由大到小的顺序是 。
(4)由上述所涉及的溶质组成以下四组等体积溶液:
甲:0.1mol/LNaA; 乙:0.1mol/LNaA和0.1mol/LHA;
丙:0.1mol/LHA; 丁:0.1mol/LNaA和0.1mol/LNaOH;
则A-离子浓度由大到小的顺序为 > > > 。(填写序号)
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
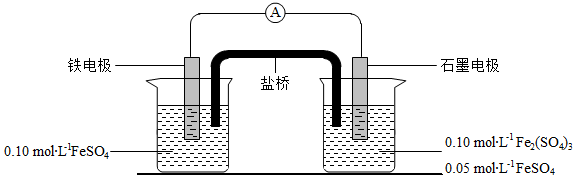
回答下列问题:
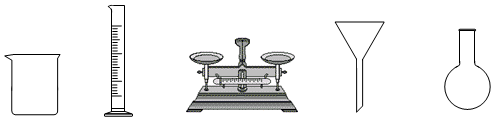
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
| 阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
| Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
| Na + |
5.19 |
NO 3 ﹣ |
7.40 |
| Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
| K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是 (填字母序号,多选倒扣分)。
a.装HCl的试管中放出H2的速率快;
b.装HA溶液的试管中入出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
。
有一份铵盐混合物,取其质量为10.00g时,含有xmol的(NH4)2SO4和ymol的NH4HSO4 。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
测定结果如下;
铵盐混合物质量为10.00g和20.00g时,浓硫酸增加的质量相同;
铵盐混合物质量为30.00g时,浓硫酸增加的质量为0.68g;
铵盐混合物质量为40.00g时,浓硫酸的质量不变。
(1)A气体的化学式为______________
(2)10.00g铵盐混合物中含有NH4+的物质的量为_____mol(用含x,y的关系式表示),10.00g铵盐混合物溶于水后可电离出H+的物质的量为___mol(用含x,y的关系式表示)。
(3)在含有2 mol NH4+与1 mol H+的溶液中加入2 molOH—,加热充分反应,可产生气体A__________ mol
(4)计算:50.00mL的NaOH溶液的浓度为__________mol/L,该铵盐中氮元素的质量分数是 %;(计算结果均保留两位小数)
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定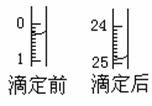
①用______式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
25.00 |
0.50 |
25.95 |
25.45 |
| 2 |
25.00 |
|
|
|
| 3 |
25.00 |
6.00 |
31.55 |
25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度(注意保留合适的有效数字)。
c(NaOH) = _____________ 。
(3)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________。(填“无影响”、“偏高”、“偏低”)
14分) DIS(Digital Information System)系统即数字化信息系统,它由传感器、数据采集器和计算机组成。DIS系统为化学教学提供了全新的技术手段和教学平台。某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。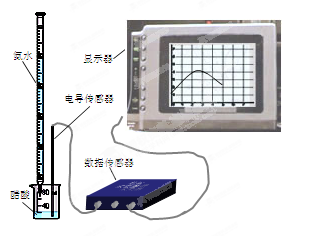
实验步骤如下:
(1)用______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如右图),向烧杯中滴加浓度为0.1000mol·L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用____________润洗2~3遍,润洗的目的是____________。
②溶液导电能力随氨水体积变化的原因是___________________ _____________________。
③食用白醋中醋酸的物质的量浓度是_____________。
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH值的变化如右图曲线关系。请回答下列问题: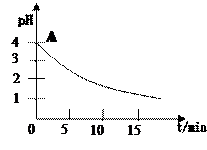
①电解前氯化铜溶液的pH值处于A点位置的原因是: (用离子方程式说明)。
②“理论派”所持观点的理论依据是: 。
③“实验派”的实验结论是 ,他们所述“精确实验”是通过
确定的。
④你持何种观点?你所持观点的理由是(从化学原理加以简述) 。
今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ E.①>②=③
D.①=③>② F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是___________。
(2)体积和物质的量浓度相同的①、②、③三 溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为_________________。
溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为_________________。
(3)当它们pH相同、体积相同时,分别加入足量锌,则开始时反应速率_________,相同状况下产生气体体积关系为____________。
(4)某学生用0.2000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
①正确操作的顺序是(用序号字母填写)______________________.
②实验中,眼睛应注视_______,直至滴定终点。 ③几次滴定消耗NaOH溶液的体积如下:
③几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该盐酸溶液的准确浓度为_____________。(保留小数点后4位)
(5)、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:____________ (错选全扣)
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润 洗
洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管