化学中常借助图像来表示某种变化过程,下列关于4个图像的说法正确的是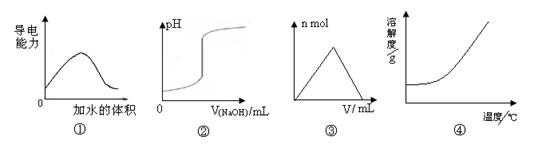
| A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化 |
| B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化 |
| C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化 |
| D.图④可表示所有的固体物质溶解度随温度的变化 |
下列叙述正确的是
| A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性 |
| B.相同温度下,完全中和相同PH、相同体积的氨水和NaOH溶液,所需相同浓度的盐酸体积相等 |
| C.0.1mol·L-1的酸式盐NaHA溶液中,c(Na+)=0.1mol·L-1≥c(A2-) |
D.向KI溶液中加入氯化银,沉淀逐渐变黄色,说明同温下 |
下列叙述正确的是
| A.当温度升高时,弱酸的电离平衡常数Ka变小 |
| B.某温度下的醋酸铵溶液呈中性,则溶液中必有c(H+)=c(OH-)=10-7mol·L-1 |
| C.pH=12氨水与pH=2盐酸等体积混合,则溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
下列有关溶液的说法正确的是
| A.向10mLpH=3的酣酸溶液中加入10mLpH=l1的NaOH溶液,混合液的pH=7 |
| B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>HCO3 |
| C.NH4CI溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH一) |
| D.向AgI沉淀中加人饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,下表各组关系可能合理的是
| 编号 |
HX |
YOH |
溶液体积 |
粒子浓度 |
| ① |
强酸 |
强碱 |
V(HX)=" V" (YOH) |
c(HX) + c(X-) = c(Y+) |
| ② |
弱酸 |
弱碱 |
V(HX)<V(YOH) |
c(X-) < c(Y+) |
| ③ |
强酸 |
强碱 |
V(HX)= V(YOH) |
c(H+)>c(YOH) + c(OH-) |
| ④ |
弱酸 |
弱碱 |
V(HX)>V(YOH) |
c(Y+) + c(H+) = c(X-) + c(OH-) |
A.①② B.②③ C.②④ D.③④
下列关于电解质溶液的叙述正确的是
| A.常温下,Na2CO3溶液的pH>7 |
| B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应 |
| C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为: c(Cl-)=c(NH4+)>c(H+)=c(OH一) |
| D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同 |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使 值增大 值增大 |
| B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
D.0.1mol·L-1某一元酸HA溶液中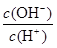 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L |
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法中
不正确的是 ( )
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+) = c(OH-) + c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-) |
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是( )
| A.Ca(OH)2的溶解度、溶剂的质量 | B.溶液中溶质的质量分数 |
| C.溶液的质量、水的电离平衡 | D.溶液中Ca2+的数目 |
从下列事实所得出的结论或给出的解释正确的是
| |
实验事实 |
结论或解释 |
| A |
将40 g NaOH溶于1 L蒸馏水中 |
该溶液的物质的量浓度为1mol﹒L-1 |
| B |
0.1 mol/L CH3COOH溶液在稀释过程中 |
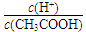 将变小 将变小 |
| C |
酸H2X为弱酸 |
常温下,盐NaHX溶液pH一定大于7 |
| D |
在溶液的稀释过程中 |
离子浓度:有的可能增大,有的可能减小,有的可能不变 |