[海南]2013年全国普通高等学校招生统一考试化学
重水()是重要的核工业原料,下列说法错误的是
| A. |
氘()原子核外有1个电子 |
B. |
与互称同位素 |
| C. |
与互称同素异形体 |
D. |
与的相对分子质量相同 |
电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:()
。有关该电池的说法正确的是
| A. | 为电池的正极 |
| B. | 负极反应为 |
| C. | 不能被 溶液激活 |
| D. | 可用于海上应急照明供电 |
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是()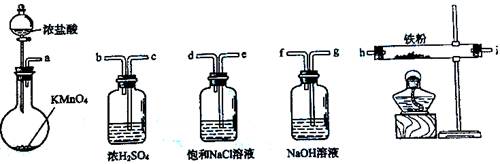
| A. |
a-b-c-d-e-e-f-g-h |
B. |
a-e-d-c-b-h-i-g |
| C. |
a-d-e-c-b-h-i-g |
D. |
a-c-b-d-e-h-i-f |
下列鉴别方法不可行的是()
| A. | 用水鉴别乙醇、甲苯和溴苯 |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D. | 用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷 |
下列烃在光照下与氯气反应,只生成一种一氯代物的有
能正确表示下列反应的离子反应方程式为
溶于过量的浓溶液中:
向明矾溶液中滴加溶液,恰好使沉淀完全:
向溶液中通入足量氯气:
醋酸除去水垢:
下列关于仪器使用的说法正确的是
下图所示的电解池I和Ⅱ中,和均为电极。电解过程中,电极和上没有气体逸出,但质量均增大,且增重。符合上述实验结果的盐溶液是
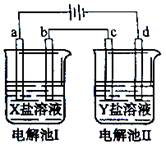
| 选项 |
||
| A. |
||
| B. |
||
| C. |
||
| D. |
、和均为短周期元素,原子序数依次增大,的单质为密度最小的气体,原子最外层电子数是其周期数的三倍,与原子最处层电子数相同。回答下列问题:
(1)、和的元素符号分别为 、、。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有、。
(3)和组成的化合物中,既含有极性共价键又含有非极性共价键的是。
此化合物在酸性条件下与高锰酸钾反应的离子方程式为;此化合物还可将碱性工业废水中的氧化为碳酸盐和氨,相应的离子方程式为。
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入,将其中的氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为和,其离子方程式为。
(2)溴与氯能以共价键结合形成。分子中,显正电性。与水发生反应的化学方程式为。
(3)分解的热化学方程式为:
在密闭容器中将过量于487下加热分解,平衡时为4.66×103。
①如反应体系的体积不变,提高反应温度,则将会(填"增大"、"不变"或"减小")。
②如反应温度不变,将反应体系的体积增加一倍,则的变化范围为。
反应在容积为1.0的密闭容器中进行,的初始浓度为0.050。温度和下的浓度与时间关系如图所示。回答下列问题:
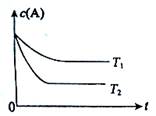
(1)上述反应的温度,平衡常数()()。(填"大于"、"小于" 或"等于")
(2)若温度时,5后反应达到平衡,的转化率为70%,则:
①平衡时体系总的物质的量为。
②反应的平衡常数=。
③反应在0~5区间的平均反应速率=。
2-丁烯是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2-丁烯与氢气反应的化学方程式为 ,反应类型为。
(2)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;A分子中能够共平面的碳原子个数为 ,A与溴的四氯化碳溶液反应的化学方程式为 。
中结晶水数目可通过重量法来确定:
①称取样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是 。
(2)计算中的(要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为,这使x的测定结果(填"偏低"、"偏高"或"不变")。
下列化合物中,同分异构体数目超过7个的有()
| A. | 已烷 | B. | 已烯 |
| C. | 1,2-二溴丙烷 | D. | 乙酸乙酯 |
肉桂酸异戊酯G(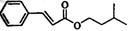 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
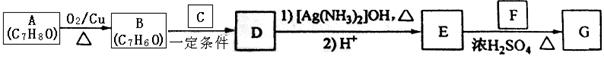
已知以下信息:
① ;
;
②为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)的化学名称为。
(2)和反应生成的化学方程式为。
(3)中含有官能团的名称为。
(4)和反应生成的化学方程式为,反应类型为。
(5)的同分异构体中不能与金属钠反应生成氢气的共有种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为(写结构简式)。
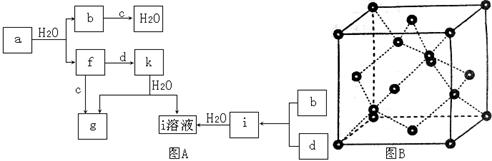
图所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图所示。
回答下列问题:
(1)图对应的物质名称是,其晶胞中的原子数为,晶体类型为。
(2)d中元素的原子核外电子排布式为。
(3)图中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为,中心原子的杂化轨道类型为。
(4)图中的双原子分子中,极性最大的分子是。
(5)k的分子式为,中心原子的杂化轨道类型为,属于分子(填"极性"或"非极性")。
下列叙述正确的是()
| A. |
合成氨的"造气"阶段会产生废气 |
| B. |
电镀的酸性废液用碱中和后就可以排放 |
| C. |
电解制铝的过程中,作为阳极材料的无烟煤不会消耗 |
| D. |
使用煤炭转化的管道煤气比直接燃煤可减少环境污染 |
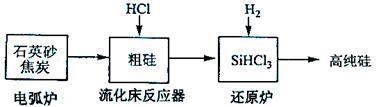
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种"金属"。这种"金属"可能是
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
| 发生的主要反应 |
|
| 电弧炉 |
 |
| 流化床反应器 |
 |
| 还原炉 |
 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为
②在流化床反应的产物中,大约占85%,还有、、等,有关物质的沸点数据如下表,提纯的主要工艺操作依次是沉降、冷凝和
| 物质 |
|||||||
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③极易水解,其完全水解的产物为
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号