常温下,将少量水加入下列物质中,相关量变化正确的是
| A.AgCl悬浊液中 c(Cl-)变小 | B.0.1mol/LCH3COOH溶液中 c(H+)变小 |
| C.0.1mol/LNa2CO3 c(HCO3-)变大 | D.0.1mol/LNH4Cl溶液中 n(OH-)变小 |
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
下列有关说法正确的是
| A.将Al2(SO4)3溶液蒸干得到Al2(SO4)3固体 |
| B.用广泛pH试纸测得某溶液pH为11.3 |
| C.向纯水通入少量HCl气体,水的电离程度减小,Kw减小 |
| D.向0.1 mol·L-1 CH3COOH溶液中加少量水,溶液中所有离子的浓度都减小 |
下列叙述正确的是( )
| A.在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变 |
| B.Na2CO3溶液加水稀释后再恢复至原温度, pH和KW均减小 |
| C.室温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)之比104:1 |
| D.25℃,若测知氨水与NH4Cl混合溶液的pH>7,则溶液中c(NH4+)>c(Cl—) |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3‑)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g) 2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能
为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
| A.①②③⑥ | B.③④⑤⑥ | C.②④⑤⑥ | D.①③④⑤ |
下列说法正确的是
| A.常温下,将pH=11的氨水稀释到原体积的10倍后,溶液的pH=10 |
| B.为确定某酸.H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1 mol/L盐酸 ③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则Ag+浓度:①>④=②>③ |
下列有关实验的原理、方法和结论都正确的是
| A.将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大 |
| B.用CH3COOH溶液作导电性实验,灯光较暗,说明CH3COOH是弱电解质 |
| C.向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有 c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO32-) |
| B.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为 NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1∶2 |
对于(NH4)2SO4溶液,下列说法正确的是
A.溶液中存在电离平衡:(NH4)2SO4 2NH4+ + SO42- 2NH4+ + SO42- |
| B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 |
| C.加水稀释,溶液中所有离子的浓度均减小 |
| D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O) |
下列说法正确的是
| A.中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 |
| B.常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
C.向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中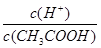 增大 增大 |
| D.一定温度下,10mL 0.50mol·L—1 NH4Cl溶液与20mL 0.25mol·L—1 NH4C1溶液含NH4+物质的量相同 |
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka 2=5.6×10-11。现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是
| A.c(HCO3-)<c(CO32-) |
| B.两溶液都能使酸性高锰酸钾溶液褪色 |
| C.c(HCO3-)>c(HSO3-) |
| D.c(CO32-)+c(HCO3-)=c(SO32-)+c(HSO3-) |
下列有关溶液中离子浓度的关系,不正确的是
| A.NaHCO3溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B.常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C.0.2 mol/LNH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+) |
| D.0.2 mol/L 的 CH3COOH 溶液中c(H+)小于0.1 mol/L 的 CH3COOH 中c(H+)的两倍 |
下列关于电解质溶液说法正确的是 ( )
| A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| B.等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA‾的电离程度大于其水解程度 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
下列叙述正确的是( )
| A.饱和的食盐水中通入HCl气体会有白色晶体析出 |
| B.同浓度的(NH4)2SO4、(NH4)2CO3、NH4Cl、NH4HSO4溶液中,c(NH4+)逐渐减小 |
| C.加入盐酸出现白色沉淀,则原溶液中一定含Ag+ |
| D.既能溶解Al(OH)3又能溶解H2SiO3的溶液可以大量共存NO3-、HCO3-、I-、K+ |
下列叙述中,正确的一组是( )
①SO2的水溶液能导电,所以SO2是电解质
②相同温度下,pH相同、体积相同的盐酸和醋酸溶液分别与足量的锌粒反应,醋酸生成的氢气较多
③在0.1mol/L CH3COOH溶液中加水稀释或加入少量CH3COONa晶体,溶液pH均增大
④室温下,将稀氨水逐滴加入到稀硫酸中,当pH=7时,c(NH4+)=c(SO42-)
⑤室温下,将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+的物质的量浓度之比为1:20
| A.①③④ | B.②④⑤ | C.②③⑤ | D.②③④⑤ |