下列说法正确的是( )
A.向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O HCO3-+OH-向正反应方向移动,则溶液pH增大 HCO3-+OH-向正反应方向移动,则溶液pH增大 |
| B.室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 |
| C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH值 |
一定条件下,下列说法正确的是
| A.常温时,把pH=1的醋酸溶液稀释10倍后,其pH=2 |
| B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大 |
| C.向氨水中加入氯化铵固体,会使溶液的pH减小 |
| D.稀释Na2CO3溶液,溶液中c(OH—)增大 |
将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
| A.c(Na+)=c(CH3COO-)+c(CH3COOH) | B.c(H+)=c(CH3COO-)+c(OH-) |
| C.c(Na+)>(CH3COO-)>c(OH-)>c(H+) | D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
25℃时,0.1 mol·L-1的下列溶液中,有关粒子的物质的量浓度关系正确的是( )
| A.CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.NH4Fe(SO4)2溶液:c(OH-)+2c(SO42-)=c(H+)+c(NH4+)+3c(Fe3+) |
| D.NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
下列液体均处于25 ℃,有关叙述正确的是 ( )。
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
下列说法正确的是( )
| A.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
| B.室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均 减小 |
| C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D.向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )。
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
25 ℃时,x mol·L-1氢氟酸水溶液中,加入KOH固体调节溶液的pH(忽略加入固体引起的溶液体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是 ( )。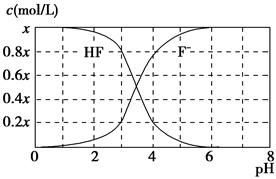
| A.当c(F-)>c(HF)时,溶液呈碱性 |
| B.当pH=2时,c(F-)<c(K+) |
| C.25 ℃时,氢氟酸的电离平衡常数为4×10-6 |
| D.当pH=5时,c(HF)+c(K+)+c(H+)-c(OH-)=x mol·L-1 |
常温时,将a1 mL、b1 mol·L-1的CH3COOH溶液加入到a2 mL、b2 mol·L-1的NaOH溶液中,下列结论中正确的是 ( )。
| A.如果a1b1=a2b2,则混合溶液的pH=7 |
| B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| C.如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) |
| D.如果a1=a2,且混合溶液的pH>7,则b1<b2 |
室温时,1 L 0.15 mol·L-1的NaOH溶液充分吸收2.24 L CO2(标准状况),然后温度恢复到室温。下列有关反应后溶液的判断正确的是 ( )。
| A.pH<7 |
| B.溶质为NaHCO3 |
| C.2c(Na+)=3[c(H2CO3)+c(HCO3—)+c(CO32—)] |
| D.c(Na+)>c(CO32—)>c(HCO3—)>c(OH-)>c(H+) |
常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )。
A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7
B.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7,则该溶液的pH一定为14-a
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是 ( )。
| A.若pH>7,则一定是c1V1=c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |