高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下:
(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。检验Fe2+是否除尽的实验操作是 。
(2)通常条件下,KSP[Fe(OH)3]=4.0×10-36,除杂后溶液中c(Fe3+)= 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是 。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作名称是 (填字母代号)
A.蒸馏 B.分液 C.过滤W ww.k s5u.co m
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.1020g;
b. 称取0.4530g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO40.4659g;
c. 称取0.4530g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0170g。
则铵明矾的化学式为 。
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
C.①和②等体积混合后的溶液:c(H+)=c(OH )+c(NH3·H2O) )+c(NH3·H2O) |
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl )>c(OH )>c(OH )>c(H+) )>c(H+) |
下列关于电解质溶液中离子关系说法中错误的是( )
| A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH) < c(Na2CO3) < c(CH3COONa) |
| B.pH = 2的HA溶液与pH = 12的MOH溶液任意比混合: c(H+) + c(M+) = c(OH-) + c(A-) |
| C.在pH=13的Na2S溶液中,Al3+、Cl-、CH3COO-不能大量共存 |
| D.由水电离出的氢离子浓度为10-1mol/L的溶液中,SO32-、NO3-、Cl-、Na+可能大量共存 |
有4种混合溶液,分别由等体积0.1 mol·L﹣1的两种溶液混合而成,①NH4Cl与CH3COONa
②NH4Cl与HCl③NH4Cl与NaCl④NH4Cl与NH3·H2O(混合液呈碱性)。下列各项排序正确的是( )
| A.pH:②<①<③<④ |
| B.c(NH4+):①<③<②<④ |
| C.溶液中c(H+):①<③<②<④ |
| D.c(NH3·H2O):①<③<④<② |
下列有关二元弱酸H2A的盐溶液的说法中,正确的是
A.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.在Na2A溶液中:c(Na+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中:c(OH-)=c(H+)+c(HA-)+2 c(H2A)
下列说法正确的是
A 向饱和食盐水中通入HCl气体,看不到明显的现象
B将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小
C 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH=7
D.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量稀硫酸,能促进水电离 |
| B.室温下,稀释0.1mol·L-1的醋酸,溶液中所有离子的浓度均降低 |
| C.往AgCl悬浊液中加入0.1mol·L-1Na2S溶液,有黑色沉淀产生 |
| D.浓度均为0.1 mol·L-1的溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
下列有关说法正确的是
A.一定条件下反应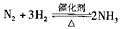 ,达到平衡时, ,达到平衡时,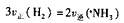 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,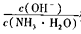 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. |
25℃时,等体积等浓度的硝酸与氨水混合后,溶液
|
| C. |
25℃时,0.1
|
| D. |
0.1
|
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
下列说法中,正确的是
| A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大 |
| C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 |
| D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32―离子浓度均增大 |
25℃时,浓度均为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是 ( )
A.存在电离平衡HCO H++CO32— H++CO32— |
B.存在水解平衡HCO+H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
| D.加入NaOH固体,恢复到原温度,c(OH-)、c(CO32—)均增大 |