有关物质的量的计算。
(1)有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为________________.若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为__________。
(2)相同质量的SO2和SO3,所含分子的数目之比为_________;所含O的物质的量之比为________。
(3)下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④0.2mol H3PO4
常温下,将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。下列说法不正确的是
| A.AgCl的溶解度大于AgBr的溶解度 |
| B.若在AgBr浊液中,加入氨水浅黄色沉淀溶解 |
| C.AgCl和AgBr见光都易分解 |
| D.AgCl与氨水反应生成Ag(NH3)2+,故氨水能使AgCl溶解 |
下列有关电解质溶液的叙述正确的是
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO) |
| D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
25℃时,用0.2mol/L HC1溶液滴定25mL 0.1mol/LNaOH溶液,右图是溶液的pH与加入HC1溶液的体积关系,图中Ⅰ、Ⅱ、Ⅲ分别代表实验不同阶段的溶液。下列有关说法不正确的是( )
| A.图中Ⅰ点对应的纵坐标a=13 |
| B.图中Ⅱ点对应的横坐标b=12.5 |
| C.图中Ⅲ点所示溶液中:c(C1—)=2e(Na+) |
| D.图中Ⅱ、Ⅲ间的任意一点所示溶液中: |
c(Na+)>c(C1—)>c(H+)>c(OH—)
某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是
| A.加入的酸过量 | B.生成的盐不水解 |
| C.酸和碱等物质的量混合 | D.反应后溶液中c(A-)=c(M+) |
下列对各种平衡体系的叙述中,完全正确的一组是
①在醋酸溶液中存在的电离平衡:CH3COOH CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
④某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
⑤在上述④的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动;
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑥⑦ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
下列有关说法正确的是
A.一定条件下反应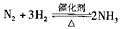 ,达到平衡时, ,达到平衡时,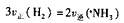 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,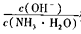 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. |
25℃时,等体积等浓度的硝酸与氨水混合后,溶液
|
| C. |
25℃时,0.1
|
| D. |
0.1
|
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
下列说法中,正确的是
| A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大 |
| C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 |
| D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32―离子浓度均增大 |