下列有关电解质溶液中粒子浓度关系正确的是
| A.CO2的水溶液中:c(H+)>c(HCO3-)=2c(CO32-) |
| B.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) |
| C.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小 |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. |
25℃时,等体积等浓度的硝酸与氨水混合后,溶液
|
| C. |
25℃时,0.1
|
| D. |
0.1
|
室温下,有关叙述正确的是
| A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐 |
| B.pH= 4.5的番茄汁中c(H+)是pH= 6.5的牛奶中c(H+)的100倍 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.pH= 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-) |
下列说法正确的是
| A.对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值小于HX溶液的pH改变值 |
| B.在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 |
| C.在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-) |
D.沉淀溶解平衡AgI Ag+ + I-的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 Ag+ + I-的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 |
下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaS04的Ksp=c(Ba2+)·c(SO42-),所以在BaS04溶液中有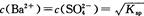
③将O.1 mol/l的NaHS溶液和O.1 mol/lNa2S溶液等体积混合,所得溶液中有2c(OH-)+c(S2-)= 2c(H+)+ c(HS-)+3 c(H2S);
④在O.1 mol/l氨水中滴加O.1 mol/l盐酸,刚好完全中和时pH=a,则由水电离产生的c (OH-)=10-amol·L-1
| A.①④ | B.②③ | C.③④ | D.①② |
下列有关说法正确的是
A.一定条件下反应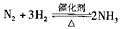 ,达到平衡时, ,达到平衡时,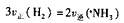 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,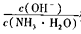 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列对各种平衡体系的叙述中,完全正确的一组是
①在醋酸溶液中存在的电离平衡:CH3COOH CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
CH3COO-+ H+加水稀释后,溶液中所有离子浓度均减小;
②常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动;
③一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
CH3COOH+OH-,使得溶液中的c(OH—)>c(H+);
④某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
2Z(g)+W(s) △H>0, 平衡后,升高温度,c(z)增大;
⑤在上述④的可逆反应中,当容器中气体压强不变时,反应达到平衡;
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动;
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑥⑦ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
根据水溶液中存在的平衡关系,判断下列说法正确的是
| A.往水中滴加少量稀硫酸,能促进水电离 |
| B.室温下,稀释0.1mol·L-1的醋酸,溶液中所有离子的浓度均降低 |
| C.往AgCl悬浊液中加入0.1mol·L-1Na2S溶液,有黑色沉淀产生 |
| D.浓度均为0.1 mol·L-1的溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
下列说法中,正确的是( )
| A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大 |
| C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 |
| D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 |
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
下列说法符合事实的是
| A.常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气 |
| B.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含Cl—、CrO42—浓度相同的溶液中滴加几滴稀AgNO3溶液时,则先生成AgCl沉淀 |
| C.电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度 |
| D.在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失 |
下列方程式不能正确解释实验事实的是
| A.铁溶于稀硝酸,溶液变黄:3Fe +8H+ +2NO3-=3Fe2++2NO↑+4H2O |
B.Na2CO3溶液能使酚酞试液变红:CO32- +H2O HCO3-+OH- HCO3-+OH- |
C.0.l mol·L-l CH3COOH溶液的pH >1: CH3COOH CH3COO-+H+ CH3COO-+H+ |
| D.向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀: |
3Mg(OH)2(s)+2Fe3+(aq)=2Fe( OH)3(s)+3Mg2+(aq)
下列化学实验事实及解释都正确的是( )
| A.向Na2SO3溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(0H)2]>Ksp[Mg(0H)2] 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(0H)2]>Ksp[Mg(0H)2] |