下列说法正确的是
| A.将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝 |
| B.向足量饱和石灰水中加入0.56 g CaO,可得固体0.74 g |
| C.由碱金属元素形成的单质熔点随原子序数的递增逐渐降低 |
| D.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性 |
常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使 值增大 值增大 |
| B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
D.0.1mol·L-1某一元酸HA溶液中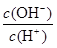 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
| A.b>a=d>c | B.a=b>c>d |
| C.a=b>d>c | D.c>a=d>b |
下列有关实验的操作正确的是( )
| |
实验 |
操作 |
| A |
配制稀硫酸 |
先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B |
排水法收集 分解产生的 |
先熄灭酒精灯,后移除导管 |
| C |
浓盐酸与 反应制备纯净 |
气体产物先通过浓硫酸,后通过饱和食盐水 |
| D |
萃取碘水中的 |
先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A |
B. | B |
C. | C |
D. | D |
(1)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH?)= 。
(3)25 ℃,有pH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为 ml;若加pH=10的氢氧化钠溶液,应加 ml。
(4)25 ℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈 性。(选填“酸”、“中”或“碱”)
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法中
不正确的是 ( )
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+) = c(OH-) + c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-) |
(4分)已知25 ℃时,0.1 mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的____________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 | C.气体NH3 | D.固体NaHCO3 |
(2)若乙的解释正确,溶液的pH应__________(填“增大”“减小”或“不变”)。(已知25 ℃时,NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5)
下列叙述正确的是
| A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-) |
| B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生 |
| C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
下列有关说法正确的是
A.一定条件下反应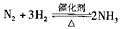 ,达到平衡时, ,达到平衡时,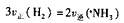 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,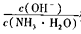 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. |
25℃时,等体积等浓度的硝酸与氨水混合后,溶液
|
| C. |
25℃时,0.1
|
| D. |
0.1
|
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
下列说法中,正确的是
| A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大 |
| C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 |
| D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32―离子浓度均增大 |