(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为: 3Fe2++2S2O32-+O2 +4OH-==Fe3O4+S4O62-+2H2O。下列说法正确的是( )
| A.O2和S2O32-是氧化剂,Fe2+是还原剂 |
| B.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
| C.每生成1 mol Fe3O4,转移电子的物质的量为2 mol |
| D.参加反应的氧化剂与还原剂的物质的量之比为1∶1 |
某温度下将Cl2通入KOH溶液里,反应后得到KCI、KC1O、KC1O3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则C12与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
| A.1:3 | B.4:3 | C.2:1 | D.3:l |
C1O2 是一种杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+ H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
| A.KClO3在反应中得到电子 | B.ClO2被氧化 |
| C.H2C2O4在反应中被还原 | D.1mol KClO3参加反应有2 mol 电子转移 |
草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取wg草酸晶体,配成100.00 mL溶液。
(2)取25.00mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol/LKMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①滴定时,KMnO4溶液应盛在__________(填酸式或碱式)滴定管中;
②若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低或无影响);
③滴定终点时,锥形瓶内溶液颜色变化是_____________________;
④若滴定终点时,共用去KMnO4溶液V mL,求x的值为________________。
已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且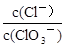 的值仅与温度高低有关。当n(NaOH)="6a" mol时,下列有关说法不正确的是
的值仅与温度高低有关。当n(NaOH)="6a" mol时,下列有关说法不正确的是
| A.改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol |
| B.改变温度,产物中NaCl的最小理论产量为4a mol |
| C.参加反应的氯气的物质的量3a mol |
D.某温度下,若反应后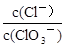 =6,则溶液中 =6,则溶液中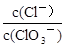 =6 =6 |
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。有关说法不正确的是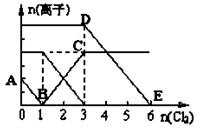
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)= 6 mol/L |
| C.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3 |
| D.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
空气污染监测仪是根据二氧化硫与溴水的定量反应来测定空气中的二氧化硫含量的。
SO 2 +Br 2 +2H 2 O  2HBr+H 2 SO 4
2HBr+H 2 SO 4
上述反应的溴来自一个装有酸性(H 2 SO 4 )KBr溶液的电解槽阳极上的氧化反应。电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO 2 含量时,空气(已除尘)以1.5×10 -4 m 3·min -1 的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10 -11 mol·s -1 ,此条件下能保持溴浓度恒定并恰好与SO 2 完全反应(空气中不含能与溴反应的其他杂质)。写出上述材料中监测过程中发生的主要的化学反应方程式及该地区空气中SO 2 的含量(g·m -3 )。
将15.6g Na2O2投入足量水中,充分反应(设能产生的气体全部放出)。
(1)涉及到的化学方程式为 ,15.6g Na2O2在该反应中转移电子的物质的量为 mol。(每空3分,6分)
(2)反应结束时生成的气体在标准状况下为 L。(要计算过程5分)
某溶液中Cl-、Br-、I- 三者物质的量之比为2︰3︰4,要使溶液中Cl-、Br-、I- 物质的量之比为1︰1︰1,则通入Cl2的物质的量是原溶液中I- 物质的量的
| A.1/2 | B.1/3 | C.1/4 | D.1/8 |
下图所示为含Cr化合物在一定条件下的转化: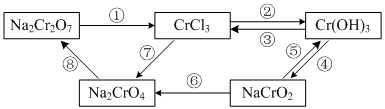
(1)①~⑧所示转化中,需要加入氧化剂才能实现的是_______(填写序号)。
(2)在上述转化中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)转化①可通过下列反应实现:
①完成并配平的化学方程式:
__Na2Cr2O7+__KI+__H2SO4——__Cr2(SO4)3+__Na2SO4+__K2SO4+__I2+__H2O
②用单线桥表示电子转移的方向和数目
③反应中每转移0.4mol电子,生成I2的物质的量为______mol。
将0.51mol铜与250mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.待产生的气体全部释放后,向溶液中加入300mL5mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是
| A.产生NO气体0.24mol | B.产生NO2气体0.26mol |
| C.原HNO3浓度为8mol/L | D.原HNO3浓度为2mol/L |
Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推。
(1)实验室用MnO2制备Cl2的反应中氧化剂是 ,氧化产物是 。将17.4g MnO2与足量的浓盐酸反应,则被氧化的HCl的物质的量为 。
(2)将溴水滴入KI溶液中的化学方程式为 。
实验室将NaClO3和Na2SO3按物质的量之比为2∶1倒入烧瓶中,同时滴入适量稀H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |