已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比为
| A.4:25 | B.2:17 | C.1:7 | D.3:8 |
在反应8NH3 + 3Cl2= 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的物质的量之比为:( )
| A.8∶3 | B.6∶1 | C.3∶1 | D.1∶3 |
在反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中,1mol还原剂失去电子的物质的量为: ( )
| A.6mol | B.8mol | C.10mol | D.12mol |
已知Cu2S与一定浓度的HNO3可发生以下反应: 3Cu2S+26HNO3=3CuSO4+3Cu(NO3)2+15NO2↑+5 NO↑+13H2O 下列说法正确的是( )
| A.Cu2S既是还原剂,又是氧化剂 | B.3mol Cu2S发生反应,有24mol电子转移 |
| C.产物中只有CuSO4是氧化产物 | D.参加反应的HNO3中有10/13氧化剂 |
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O ;
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
(5)KMnO4在酸性溶液中发生还原反应的反应式:
“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN+H2O2+H2O=A+NH3↑
(1)生成物A的化学式为
(2)在标准状况下有0.448L氨气生成,则转移的电子数为
(3)反应中被氧化的元素为
(4)H2O2被称为绿色氧化剂的理由是
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为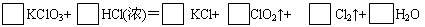
(1)请配平上述化学方程式(计量数填入框内)
(2)浓盐酸在反应中显示出来的性质是___________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的物质的量为________mol。
在2KMnO4 +16HCl ="==" 2KCl +2MnCl2 + 5Cl2↑+8 反应中
| A.Cl2是还原产物 |
| B.处对应的物质为H2O |
| C.氧化剂与还原剂物质的量之比为1∶8 |
| D.若1mol KMnO4参加反应,转移的电子的物质的量是5mol |
在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,
(1)m=________(填数字)
(2)R3+是___________(填氧化产物、还原产物)
(3)用双线桥法表示电子转移的方向和数目___________
(4)若氧化等量的R2+,消耗的高锰酸钾与氧气的物质的量之比为___________,
a mol FeS与b mol FeO投入到V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )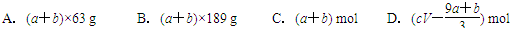
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
| A.5∶3 | B.5∶4 | C.1∶1 | D.3∶5 |
亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物是
| A.NH3 | B.N2 | C.N2O3 | D.HNO3 |
在热的稀硫酸溶液中溶解了45.6gFeSO4。当加入200mL0.5mol•L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是
| A.N2O | B.NO | C.N2O3 | D.NO2 |
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |