已知反应3S+6KOH(浓) 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )
2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )
| A.3∶1 | B.1∶3 | C.2∶1 | D.1∶2 |
下列反应中,氧化剂与还原剂的物质的量之比为2 :1的是 ( )
| A.Zn + 2HCl = ZnCl2 + H2↑ |
| B.Cu +2 H2SO4(浓) = CuSO4 + SO2↑+ 2H2O |
| C.3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O |
| D.2Na + Cl2 = 2NaCl |
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为
| A.1/5 mol | B.2/5 mol | C.3/5mol | D.11/5 mol |
已知反应:2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是_______________________
(2)用单线桥法表示反应中电子转移的方向和数目
2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为_______________________
在氧化还原反应:2H2S + SO2 =" 3S" + 2H2O中,被氧化与被还原的硫原子数比是( )
| A.1:1 | B.1:2 | C.3:2 | D.2:1 |
用15.8g KMnO4氧化75mL足量浓盐酸。反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)有多少克HCl被氧化?
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?
在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化的NH3的质量为 ( )
| A.13.6g | B.10.2g | C.6.8g | D.3.4g |
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
| A.2 | B.3 | C.4 | D.5 |
亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物是
| A.NH3 | B.N2 | C.N2O3 | D.HNO3 |
现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
| A.产生的气体是0.2molNO2 |
| B.硝酸的物质的量浓度为12mol/L |
| C.反应中被还原和未被还原的硝酸物质的量之比为3:2 |
| D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol |
Na2S2O3可作为脱氧剂,已知25.0mL0.100mol·L-1Na2S2O3溶液恰好与224mL(标准状况下)Cl2完全反应,则S2O32—将转化成
| A.S2- | B.S | C.SO32— | D.SO42— |
a mol Cu与含b mol HNO3的溶液恰好完全反应,则被还原的HNO3的物质的量一定是
| A.(b-2a) mol | B.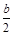 mol mol |
C. mol mol |
D.2a mol |