H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。
(1)H2O2不稳定,其生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快其分解,且Fe2+和Fe3+各自的量保持不变。
①2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O
② (填离子方程式)。
(2)H2O2的水溶液显弱酸性,写出一个用盐酸制取H2O2的化学方程式__________________。
(3)H2O2在使用中通常不会带来污染。
①工业上利用Cl2 + H2O2 =" 2HCl" + O2除氯,在此反应中被氧化的物质是______________。
②消除某废液中的氰化物(含CN-),完成下列反应:
CN- + H2O2 + H2O=____________ + NH3↑
(4)实验室常用酸性KMnO4溶液测定H2O2的浓度。
取10.00 mL H2O2溶液样品(密度近似为1g/mL)于锥形瓶中,加水到50.00 mL,当滴入0.10 mol/L KMnO4 溶液40.00 mL后,恰好完全反应。则原样品中H2O2的质量分数是_______________。
(7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为 296kJ·mol
296kJ·mol 。
。
在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2+ (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是
(2)当反应有3.612×1024个电子转移时被硝酸钾氧化得到的氧化产物在标准状况下的体积 。
氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶 液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是
工业上利用电解饱和食盐水可制得重要化工产品。
(1)写出化学方程式并标出电子转移的方向和数目:
(2)氧化剂:
还原剂:
(3)每转移1mol电子,可得到 mol氯气;
利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t。
(8分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式_____________________________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,为使用方便,请计算出该浓盐酸
的物质的量浓度______________。
难溶于水的二硫化亚铁(FeS2)是黄铁矿的主要成分,它溶于稀硝酸的反应为:FeS2 +4HNO3="Fe(NO3)3+2S" + NO↑+2H2O
(1)将反应改写成离子反应方程式_________________________。
(2)用标出电子转移方向和数目:
FeS2 +4HNO3="Fe(NO3)3+2S" +NO↑+2H2O
(3)反应中氧化剂是_______;还原剂是_______。
(4)当反应中转移0.3mol电子,被还原的硝酸的物质的量为_______;可产生标态下NO气体的体积是_______L。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 ="=" 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)上述反应中氧化剂与氧化产物的物质的量之比 。
(2)若生成NO的体积为3.36L(标准状况),且硝酸足量,则消耗铜的质量 g,转移电子的数目为 ,被还原的硝酸为 mol。
(3)写出该反应的离子方程式 。
海水中含有非常丰富的化学资,从海水中可提取多种化工原料。下图是某工厂对海水资综合利用的示意图。
试回答下列问题:
(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,方法是将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液,合理的操作顺序是 ①③(填序号)。
(3)写出电解饱和食盐水的化学方程式 ,当转移0.2mol电子时,阴阳两极生成的气体体积之和是 (标准状况下)。
(4)以海边贝壳为原料可以制取石灰乳,贝壳的主要化学成分为 (写化学式)。
(5)目前,世界上生产的镁有60%自海水,由“母液”制“镁”的过程中,发生了 个复分解反应(填数目)。
(6)电解氯化镁所得的氯气,除用于生产盐酸外,还可以用于制取漂白粉,漂白粉的有效成份
是 (写化学式)。
(7)溴主要以Br-形式存在于海水中,提取食盐后剩下的母液(也叫卤水)中,Br-的浓度较大,工业上 制备的Br2的操作步骤为:一定条件下,将Cl2通入卤水中,生成Br2,利用热空气将Br2吹出,Br2可用热空气吹出,其原因是 。
(10分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol-1
2SO3(g) ΔH=−196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol-1
2NO2(g) ΔH=−113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
Fe、Ca是重要的金属元素。运用所学知识,回答下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式: ;
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是 ;
②验证该溶液中含有Fe2+,正确的实验方法是 ;
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
②每消耗草酸0.5mol,转移电子的物质的量为 mol;
③此人血液中的Ca2+的浓度为 mol·L-1。
(6分)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程:
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
(1)硫化氢具有还原性,可以和许多氧化剂反应。H2S通入硫酸酸化的KMnO4溶液,反应生成S、MnSO4等,写出该反应的化学方程式: 。
(2)硫铁矿氧化焙烧的化学反应如下:

若24mol FeS2完全反应耗用氧气1467.2L(标准状况);反应产物中Fe3O4与Fe2O3物质的量之比为 。
(3)在常温常压下氢气与氧气的混合气体10L,将混合气体点燃充分反应后恢复到原来状况剩余气体1L,则原混合气体中氢气和氧气的体积比为
(4)将钠—铝合金共a 克,投入足量水中生成气体最多 mol,如果投入到足量的稀硫酸中生成气体体积最多 mol(用含a的代数式表示,上同)
某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀CuI。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
已知:I2+2S2O32-=S4O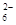 +2I-
+2I-
①可选用_____作滴定指示剂,滴定终点的现象是_______________________________ 。
②CuCl2溶液与KI反应的离子方程式为_______________________________________。
③该试样中CuCl2·2H2O的质量百分数为________。