某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程: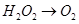
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程: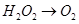
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。