(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是 物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。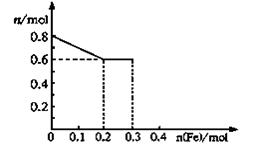
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸的冶炼钢铁的重要原料。高温下可发生反应:其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
6SO2+Fe3O4,该过程若有1.5mol FeS2参加反应,则反应过程中转移_____ mol电子;
(2)氯化铝溶液显酸性,原因是_________________________(用离子方程式稀释);
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2;它易被氧化),原理如下图所示。
①电源的负极为_________(填“A”或“B”)。
②阳极室中发生的反应依次为_________、_________。
③电解结束后,阴极室溶液的pH与电解前相比将_________;若阴极共收集到气体6.72L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
(4)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
H2O(g)═H2O(l)△H=-44.0kJ•moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:_________。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO2- |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。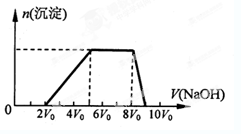
①该溶液中一定含有的阳离子是____________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
| n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
| n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。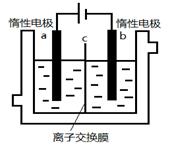
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
(12分)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH= 。
(2)丙溶液中存在的化学平衡有 (用离子方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 。
(4)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、钥匙、玻璃棒、烧杯、量筒外,还需 (填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是
。
③某同学设计的下列滴定方式中,最合理的是 (夹持部分略去,填字母序号),达到滴定终点的现象是 。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。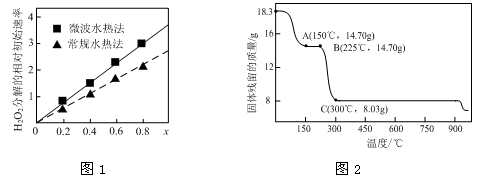
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的 I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2, 溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ 。向反应后的溶液中通入过量CO2,反应的离子方程式为 _______________________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1) 表示阿伏加德罗常数的数值,69g
表示阿伏加德罗常数的数值,69g 和
和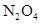 的混合气体中含有__________个氧原子;2L 0.6 mol/L
的混合气体中含有__________个氧原子;2L 0.6 mol/L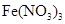 溶液中含_________个
溶液中含_________个 离子。
离子。
(2)三氟化氮( )是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: 、
、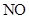 和
和 ,
,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol  ,转移的电子数目为________个.
,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到: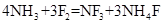 ;据题意推测
;据题意推测 ,
, ,
,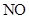 三种气体中,氧化性由强到弱的顺序为____________________
三种气体中,氧化性由强到弱的顺序为____________________
③ 是一种无色、无臭的气体,一旦
是一种无色、无臭的气体,一旦 泄漏,可以用
泄漏,可以用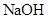 溶液喷淋的方法减少污染,其产物除
溶液喷淋的方法减少污染,其产物除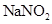 、
、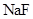 、
、 外,还肯定有_____________(填化学式).
外,还肯定有_____________(填化学式).
(3)氨和联氨(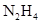 )是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
(每空2分,共6分)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为: C+
C+ K2Cr2O7+
K2Cr2O7+ H2SO4→
H2SO4→ CO2↑+
CO2↑+ K2SO4+
K2SO4+ Cr2(SO4)3+
Cr2(SO4)3+ H2O
H2O
(1)完成并配平上述反应的化学方程式并标出电子转移方向与数目(单线桥法);
___
(2)此反应的氧化产物是__ __;
(3)上述反应中若产生0.1 mol CO2气体,则转移电子的物质的量是__0.4__ mol。
碳、硅、锗、锡、铅的单质及化合物是重要的工业材料。
(1)金刚石和石墨是碳的两种同素异形体,相同条件下石墨更稳定,则石墨转化为金刚石的反应是______(填“放热”或“吸热”)反应。
(2)SiO2在通信领域的一种重要用途是______。SiO2晶体中的基本结构单元是_____。
(3)SnCl2有较强的还原性,写出SnCl2与FeCl3溶液反应的离子方程式 。
(4)铅丹(Pb3O4)可作为防锈用涂料,呈红褐色。可采用PbS在空气中连续氧化的方法制备:PbS →PbO→Pb3O4,写出第一步氧化的化学方程式 。铅丹曾用于铁制品防锈,请说明它的主要危害 。1 mol铅丹与足量浓盐酸反应时,转移的电子数目为2 NA,写出该反应的化学方程式 。
(5)金属锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,可能的原因是: 。
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴试写出Pb2O3与浓盐酸反应的化学方程式__________________________
⑵通过计算确定y与a、x的函数关系式____________________
⑶若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为____;其物质的量之比为________________。