氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
碘化钾溶液久置于空气中,发生如下反应:
______KI+______O2+______H2O=______I2+______KOH
(1)在______上填上正确的化学计量数并用双线桥法标出电子转移的方向和数目;
(2)在该反应中,还原产物是________(填化学式);
(3)当有0.2mol电子发生转移时,生成I2的质量为________g。
危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)  2KCl+2MnCl2+5Cl2↑+8H2O。
2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为____________(标准状况),被氧化的HCl的物质的量是___________________。
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H=Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为________mol。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
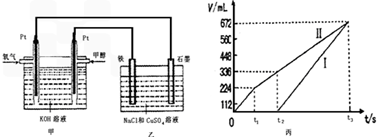
(4)写出甲中通入甲醇这一极的电极反应式________________________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_______g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
测血钙的含量时,可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 mol/L。
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1) 表示阿伏加德罗常数的数值,69g
表示阿伏加德罗常数的数值,69g 和
和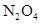 的混合气体中含有__________个氧原子;2L 0.6 mol/L
的混合气体中含有__________个氧原子;2L 0.6 mol/L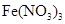 溶液中含_________个
溶液中含_________个 离子。
离子。
(2)三氟化氮( )是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: 、
、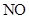 和
和 ,
,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol  ,转移的电子数目为________个.
,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到: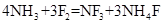 ;据题意推测
;据题意推测 ,
, ,
,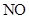 三种气体中,氧化性由强到弱的顺序为____________________
三种气体中,氧化性由强到弱的顺序为____________________
③ 是一种无色、无臭的气体,一旦
是一种无色、无臭的气体,一旦 泄漏,可以用
泄漏,可以用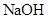 溶液喷淋的方法减少污染,其产物除
溶液喷淋的方法减少污染,其产物除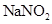 、
、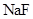 、
、 外,还肯定有_____________(填化学式).
外,还肯定有_____________(填化学式).
(3)氨和联氨(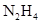 )是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,由此说明ClO2具有___________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2==="=" 2ClO2+____________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O+I2===S4O+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:
请回答:
①操作Ⅰ中反应的离子方程式是__________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是__________mg·L-1。
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为
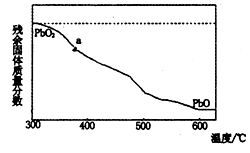
已知PbO2与硝酸不反应且氧化性强于硝酸,而PbO是碱性氧化物,能和酸反应,写出上述分解产物与硝酸反应的化学方程式
(2)①另一实验小组也取一定量的PbO2加热得到了一些固体,为探究该固体的组成,取一定质量该固体加入到30 mLCH3COOH一CH3COONa溶液中,再加入足量KI固体,摇荡锥瓶使固体中的PbO2与KI全部反应而溶解,得到棕色溶液。写出PbO2参与该反应的化学方程式 ,用淀粉指示剂,0.2 mol/L的Na2S2O3标准溶液滴定至溶液蓝色刚消失为止,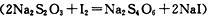 ,Na2S2O3标准溶液的消耗量为20 mL。
,Na2S2O3标准溶液的消耗量为20 mL。
②固体加入到醋酸而非盐酸中是因为会产生有毒气体,写出反应的化学方程式
用CH3COOH一CH3COONa的混合液而不用CH3COOH可以控制pH不至于过低,否则会产生浑浊和气体,请写出该反应的化学方程式
③取相同质量的上述固体与硝酸混合,过滤出的滤液加入足量的铬酸钾溶液得到铬酸铅(PbCrO2相对分子质量323)沉淀,然后 ,得固体质量为0.969g,依据上述数据,该固体的分子式 。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
下图所示为含Cr化合物在一定条件下的转化: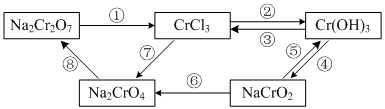
(1)①~⑧所示转化中,需要加入氧化剂才能实现的是_______(填写序号)。
(2)在上述转化中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)转化①可通过下列反应实现:
①完成并配平的化学方程式:
__Na2Cr2O7+__KI+__H2SO4——__Cr2(SO4)3+__Na2SO4+__K2SO4+__I2+__H2O
②用单线桥表示电子转移的方向和数目
③反应中每转移0.4mol电子,生成I2的物质的量为______mol。
(1)2015年8月12日天津港危化品爆炸,教训极为深刻。其中化学品之一是氰化钠(NaCN):白色固体,可溶于水,剧毒,致死量50~250mg。氰化钠遇水或酸生成剧毒易燃的氰化氢(HCN)气体。处理氰化物可用碱性氯化法,该方法发生三步反应,写出其离子方程式。
①氯气与氢氧化钠溶液反应生成次氯酸盐(ClO-): 。
②次氯酸盐氧化氰化物(CN-)生成氰酸盐(CNO-):ClO-+CN-=CNO-+2Cl-
③过量的次氯酸盐氧化氰酸盐生成CO32-和N2: 。
(2) 用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2。若处理含NaCN 4×10-5mol·L-1的废水 1000L,至少需要ClO2的质量为___________g。
(3)化学是一门以实验为基础的科学,下列叙述正确的是______(填写序号).
①将0.2mol•L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出。
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管。
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线。
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶。
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾。
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有 。
。
(4)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
| A.定性检验SO32-,可用HNO3酸化的BaCl2溶液 |
| B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 |
| C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 |
| D.检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液 |
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关.当n(KOH)="a" mol时,
的值与温度高低有关.当n(KOH)="a" mol时,
(1)标准状况下,参加反应的氯气的体积等于 L
(2)若某温度下,反应后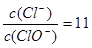 ,则溶液中
,则溶液中 = ,此时反应总离子方程式为 .
= ,此时反应总离子方程式为 .
(3)改变温度,产物中KClO3的最大理论产量为 mol.