2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C1O2和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C1O2的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: 。
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示:
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为 。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-) (若不存在,此问不必作答)。
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+__________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O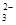 +I2===S4O
+I2===S4O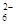 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示: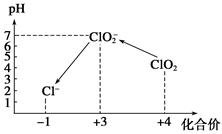
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。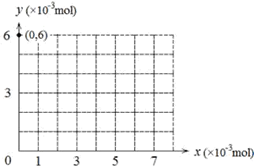
查阅资料如下:
①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3-+ I2 = 2IO3-+ Br2
③ IO3-+ 5I-+ 6H+ = 3I2 + 3H2O ④ 2IO3-+ 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步 骤 |
现 象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁
与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物
为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析
下图,回答有关问题。
假设曲线的各段内只有一种还原产物。
(1)0点到a点的还原产物是 ________ __。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 ________ 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 ___________。
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
某稀硫酸和硝酸的混合溶液200 mL,分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。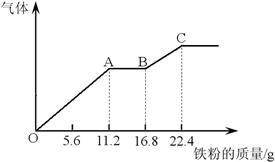
(1)第二份溶液中最终溶质为 ;
(2)OA段产生的气体是 (填化学式),BC段产生的气体是 (填化学式),AB段的反应为 ;
(3)原混合酸中HNO3的物质的量为 mol,H2SO4的物质的量浓度应为 mol/L。
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是 物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。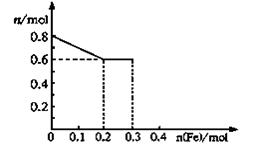
有一瓶(约100mL)硫酸和硝酸的混合溶液,取出10.00mL该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得4.66g沉淀。滤液跟2.00mol/LNaOH溶液反应,共用去35.00mL碱液时恰好中和。试完成下列填空:
(1)则混合溶液中硝酸的物质的量浓度c (HNO3) = _______________mol/L
(2)另取10.00mL原混酸溶液,加入1.60g铜粉共热,反应的离子方程式为:__________________________________在标准状况产生的气体体积为________ mL。(写出必要的计算过程)
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO2- |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。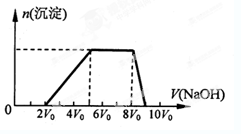
①该溶液中一定含有的阳离子是____________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
| n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
| n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
(6分) 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。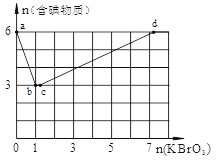
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 ________。
(3)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中可能观察到的现象为 。
(12分)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH= 。
(2)丙溶液中存在的化学平衡有 (用离子方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 。
(4)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、钥匙、玻璃棒、烧杯、量筒外,还需 (填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是
。
③某同学设计的下列滴定方式中,最合理的是 (夹持部分略去,填字母序号),达到滴定终点的现象是 。
【化学—选修2化学与技术】
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是_________________________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因_____________________。
(3)②中反应后无气体放出,该反应的离子方程式为____________________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)
【化学------必修】(15分)
Ⅰ、在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。
请回答下列问题:
(1)b点时,对应含碘物质的化学式为 。
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式并标出电子转移方向与数目 。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为 。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为 。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为 。
Ⅱ、(6)氨水和NH4Cl等物质的量混合配制成的稀溶液,c(Cl-)<c(NH4+),下列说法错误的是( )
A氨水的电离作用大于NH4Cl的水解作用 B氨水的电离作用小于NH4Cl的水解作用
C氨水的存在抑制了NH4Cl的水解 DNH4Cl的存在抑制了氨水的电离
E、 c(H+)>c(OH-) F、 c(NH3•H2O)>c(NH4+)
G、c(NH3•H2O)+c(NH4+)=2c(Cl-) H、c(NH3•H2O)+c(OH-)=c(Cl-)+c(H+)
钨是重要的战略元素,钨可以制造枪械、火箭推进器的喷嘴、切削金属,是一种用途较广的金属。工业上从经过预处理的钨矿原料(主要成分是FeWO4、MnWO4还含有Si、P、As的化合物等)制备WO4,然后通过煅烧还原三氧化钨生产钨粉。其中生产WO3的流程如下:同答下列问题: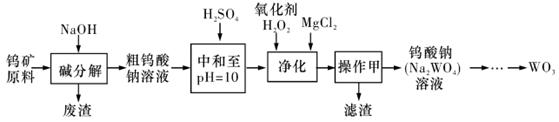
(1)上述流程中,操作甲的名称是_____________________________________________。
(2)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等。加入H2O2的目的是_______,其离子方程式为:___________________________________________。
(3)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示。钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系表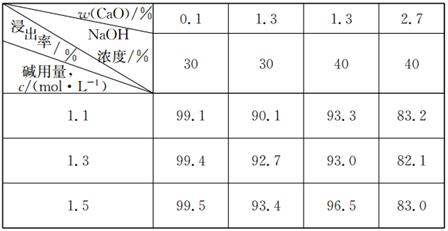
注:碱用量的单位为理论量的倍数
下列说法正确的是
| A.增大NaOH浓度,浸出率增大 | B.增大碱用量,浸出率一定增大 |
| C.增大碱用量,浸出率一定减小 | D.原料中CaO的含量增大,则浸出率增大 |
(4)在“净化”阶段,加入MgCl2的目的是使混合溶液中的其余酸根离子沉淀下来。此时尽量使溶液pH=10,以免产生Mg(OH)2沉淀,溶液中c(Mg2+ )应不超过_______(Ksp[Mg(OH)2]=5.6×10-12)。