已知反应:2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是_______________________
(2)用单线桥法表示反应中电子转移的方向和数目
2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为_______________________
在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,
(1)m=________(填数字)
(2)R3+是___________(填氧化产物、还原产物)
(3)用双线桥法表示电子转移的方向和数目___________
(4)若氧化等量的R2+,消耗的高锰酸钾与氧气的物质的量之比为___________,
⑴在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 元素被氧化; ________是氧化产物;7mol HCl参与反应时转移的电子总数为_____mol.
⑵反应11P +15CuSO4 +24H2O = 5Cu3P + 6H3PO4 +15H2SO4中32g CuSO4能氧化磷的质量为_________g.
某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HC l(浓)、KCl,其中Cl2、H2O均为生成物。
l(浓)、KCl,其中Cl2、H2O均为生成物。
(1)该反应中的氧化剂是 ,氧化产物为 。
(2)该反应中,氧化产物与还原产物的物质的量之比为 。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程 中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
(4)购买的浓盐酸(密度为1.19g/cm3)在工业上是用HCl气体(标准状况)与H2O按体积比500:1配制成的,则该盐酸的物质的量浓度是 mol/L(结果保留一位小数)。
在反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,氧化剂是__________,还原剂是__________;氧化剂具有__________性;被氧化和被还原的原子数之比是__________。
(1)质量都为3 g的镁和铝,物质的量之比为 ;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的盐酸的物质的量之比为 。
(2)在50 mL NaNO3和Na2SO4的混合溶液中,c (Na+) =" 1" mol/L,往其中加入50 mL BaCl2溶液恰好完全反应,后得到2.33 g白色沉淀,则原混合溶液中c (NO3-)= mol/L。
(3)已知Cu3P中P为 -3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,①被氧化的P和被还原的P的物质的量之比为 ;
②当有8 molH2O参加反应,上述反应转移的电子数目约为 个;
③上述反应中7.5 mol CuSO4氧化的P原子的物质的量为 。
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为 。
(2)反应 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:
2KMnO4 + 16HCl =" 2KCl" + 2MnCl2+ 5Cl2↑+ 8H2O
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂 mol,被氧化的物质的质量为 g。
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目
(2)2.8gCO的物质的量为 mol,含有 个原子,完全与氧化铜反应时失去电子 mol。
氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列反应中电子转移发生在相同价态的同种元素之间的有________(填反应编号,下同);电子转移发生在不同价态的同种元素之间的有________;电子转移发生在不同元素之间的有__________。下列反应中转移电子数为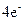 的有_____________。
的有_____________。
①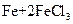 ===
===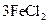
 ②
②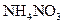

 ③
③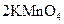
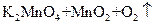
 ④
④
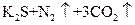
⑤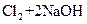 ===
===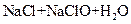
 ⑥
⑥
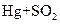
右图为实验室某浓盐酸试剂瓶的标签上的有关
数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
若用KMnO4氧化上述 HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(2)该反应中的氧化剂是 、氧化产物
是 。
(3)1mol KMnO4完全反应,被还原的HCl的物质的量为 mol。
(4)8mol HCl完全反应,产生的Cl 2在标准状况下的体积为 升。
在 K2Cr2O7 + 14HCl ="===" 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
="===" 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂,氧化产物是 ;
(2)此反应若转移了12mol的电子,则生成氯气 L(标准状况)
K2Cr2O7(橙色)、Cr2(SO4)3(绿色)、K2SO4、H2SO4、C2H5OH、CH3COOH和H2O分别属于同一氧化还原反应中的反应物和生成物,该反应原理可以用于检查司机是否酒后开车。
(1)该反应中的还原剂是________________。
(2)若司机酒后开车,检测仪器内物质显示出 色。
(3)在反应中,铬元素的化合价从 价变为 价。
(4)写出并配平该反应的化学方程式。
(5)如果在反应中生成1mol氧化产物,转移的电子总数为 。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:
C+ + H2SO4→ K2SO4+ + Cr2(SO4)3+ H2O
(3)H2SO4在上述反应中表现出来的性质是(填选项编号) 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为 。
(5)若将一定量的上述气体通入含0.1molNaOH的溶液中,小心加热蒸干,可得7.16g固体,则在加热前溶液中离子浓度的大小关系是 。
I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,将计量数填在方框内。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO-经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为 。