江苏省南通市高三第一次模拟化学试卷
2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者。人类借助于这种显微镜可以观察到单个的蛋白质分子。下列有关叙述不正确是
| A.蛋白质中含有碳、氢、氧、氮等元素 |
| B.蛋白质属于高分子化合物 |
| C.蛋白质可完全水解生成氨基酸 |
| D.消毒过程中细菌蛋白质发生了盐析 |
下列有关化学用语表示正确的是
| A.质子数为92、中子数为143的铀(U)原子: 92235U |
B.过氧化氢的电子式: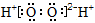 |
C.氯离子的结构示意图: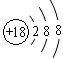 |
D.1,3—二甲基丁烷: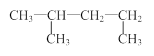 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的无色溶液中:Na+、Cu2+、Cl-、CO32- |
| B.使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl- |
| C.0.1 mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO- |
| D.由水电离出的c(H+)=1×10-10mol/L的溶液中:Mg2+、NH4+、SO42-、HCO3- |
下列各装置能够达到相应实验目的的是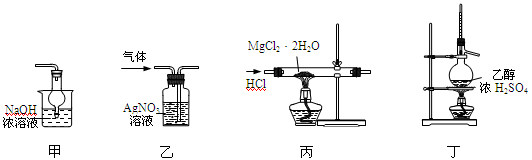
| A.用装置甲除去乙酸乙酯中混有的少量乙酸 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙制取无水MgCl2 |
| D.用装置丁制取乙烯 |
下列物质性质与应用对应关系正确的是
| A.氨气具有还原性,可用作制冷剂 |
| B.Na2O2呈浅黄色,可用作潜水艇中的供氧剂 |
| C.明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂 |
| D.碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.0.1 mol溴苯中含有双键的数目为0.3NA |
| B.0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA |
| C.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
| D.标准状况下,11.2L 由H2和CO组成的混合气体中含有分子的数目为0.5NA |
下列指定反应的离子方程式正确的是
| A.Na2SO3溶液中滴加稀H2SO4:SO32- + 2H+=SO2↑+ H2O |
| B.向AlCl3溶液中滴入足量的浓氨水:Al3+ + 4OH- = AlO2- + 2H2O |
| C.Ca(ClO)2溶液中通入少量CO2:2ClO- + CO2 + H2O ="2HClO" + CO32- |
| D.Fe(NO3)2溶液中加入过量的HI溶液:2Fe3++2I—=2Fe2++I2 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| |
甲 |
乙 |
丙 |
| A |
Na |
H2O |
Cl2 |
| B |
Al |
Fe2O3 |
稀H2SO4 |
| C |
CH3CH2OH |
NaOH溶液 |
CH3COOH |
| D |
Ba(OH)2溶液 |
CO2 |
Na2CO3溶液 |
短周期主族元素X、Y、W、Z、R的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2-具有相同的核外电子数,R是同周期中原子半径最小的元素。下列叙述正确的是
| A.Y2-的离子半径大于W3+的离子半径 |
| B.Y、Z形成的化合物为离子化合物 |
| C.W的最高价氧化物对应的水化物的酸性比X的强 |
| D.Z的气态简单氢化物的稳定性比R的强 |
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2
(3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
| A.△H1>0,△H2<0 | B.△H5=2△H2+△H3-△H1 |
| C.△H3>0,△H5<0 | D.△H4=△H1-2△H3 |
下列有关说法正确的是
| A.马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀 |
B.CH3Cl(g)+Cl2(g) CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 |
| C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS) |
| D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
某药物中间体X,其结构如图所示。下列说法正确的是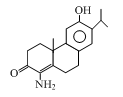
| A.X分子中含有手性碳原子 |
| B.X可发生氧化、消去、取代等反应 |
| C.X既能与盐酸反应,又能与NaOH溶液反应 |
| D.1mol X与H2反应,最多消耗4mol H2 |
探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
| A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 |
| B.将pH=11的氨水稀释1000倍,测得pH > 8,说明NH3·H2O为弱碱 |
| C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 |
| D.将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2 |
向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液至恰好反应完全,下列说法正确的是
| A.整个反应过程中:c(H+) + c(Na+) + c(NH4+)=c(OH-) + 2c(SO42-) |
| B.当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+) |
| C.当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+) |
| D.当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-) |
一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
| 编号 |
温度(℃) |
起始物质的量 (mol) |
平衡物质的量 (mol) |
达到平衡所需时间 (s) |
|
| PCl5(g) |
PCl3(g) |
Cl2(g) |
|||
| Ⅰ |
320 |
0.40 |
0.10 |
0.10 |
t1 |
| Ⅱ |
320 |
0.80 |
|
|
t2 |
| Ⅲ |
410 |
0.40 |
0.15 |
0.15 |
t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=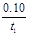 mol/(L·s)
mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。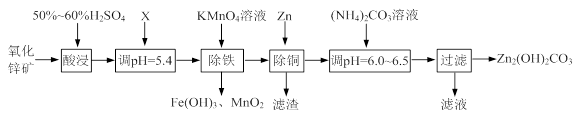
(1)“酸浸”时保持H2SO4过量的目的是 。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式: 。
②流程中调节pH=5.4所加试剂X为 (填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由 。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。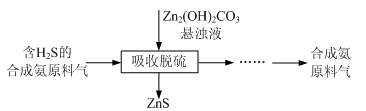
福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成: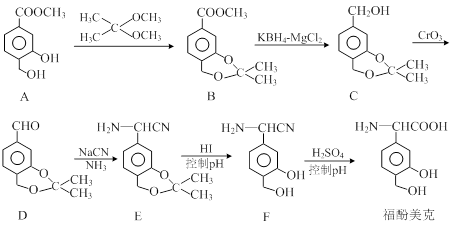
(1)B中的含氧官能团有 和 (填名称)。
(2)C→D的转化属于 反应(填反应类型)。
(3)已知E→F的转化属于取代反应,则反应中另一产物的结构简式为 。
(4)A(C9H10O4)的一种同分异构体X满足下列条件:
Ⅰ.X分子有中4种不同化学环境的氢。
Ⅱ.X能与FeCl3溶液发生显色反应。
Ⅲ.1mol X最多能与4 mol NaOH发生反应。
写出该同分异构体的结构简式: 。
(5)已知: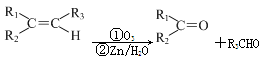 ,根据已有知识并结合相关信息,写出以
,根据已有知识并结合相关信息,写出以 为原料制备
为原料制备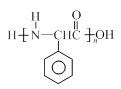 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br CH3CH2OH
CH3CH2OH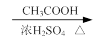 CH3COOCH2CH3
CH3COOCH2CH3
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。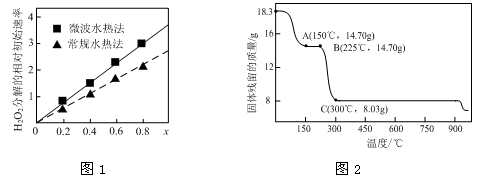
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2: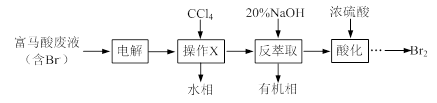
(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下: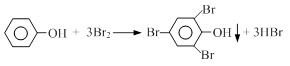
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。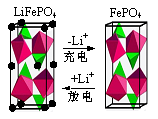
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。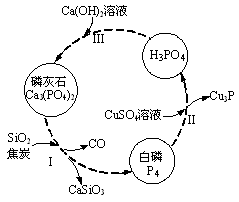
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol Fe(CN)63-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。
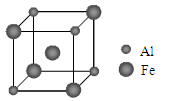
该合金的化学式为 。
B.[实验化学]
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】
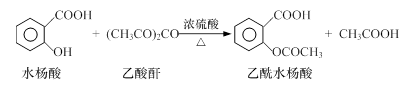
【物质性质】
| 试剂 |
沸点(℃) |
溶解度 |
化学性质 |
||||
| 水杨酸 |
211 |
微溶于冷水,易溶于热水 |
|
||||
| 乙酸酐 |
139 |
在水中逐渐分解 |
|
||||
| 乙酰水杨酸 |
|
微溶于水 |
与碳酸钠反应生成水溶性盐 |
【实验流程】
(1)物质制备:向125 mL的锥形瓶中依次加入4 g水杨酸、10 mL乙酸酐(密度为1.08g/mL)、0.5 mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10 min。
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是 。
②控制反应温度85℃~90℃的原因 。
(2)产品结晶:取出锥形瓶,加入50 mL蒸馏水冷却。待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干。简要叙述如何洗涤布氏漏斗中的晶体? 。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸3.6 g。
①试剂X为 。
②实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号