有下列三个反应:
①Cl2+FeI2=FeCl2+I2;②2Fe2++Br2=2Fe3++2Br-;③CO2O3+6HCl=2COCl2+Cl2↑+3H2O下列说法正确的是
| A.① ② ③中的氧化产物分别是I2、Fe3+、COCl2 |
| B.根据以上方程式可以得到氧化性Cl2>Fe3+>CO2O3 |
| C.可以推理得到Cl2+FeBr2=FeCl2+Br2 |
| D.在③反应中当1mol CO2O3参加反应时,2mol HCl被氧化 |
臭氧具有强氧化性,可使湿润的碘化钾淀粉试纸变蓝,有关反应如下:O3 + 2KI + H2O =2KOH + I2 + O2,对于此反应下列说法正确的是:( )
| A.反应中O3是氧化剂,H2O和KI是还原剂 |
| B.在反应中,每消耗1molO3转移2mol电子 |
| C.氧化产物I2和还原产物O2的物质的量之比为1∶1 |
| D.由此反应可知,氧化性强弱顺序为O3>I2>O2 |
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S + 3O2 →2Cu2O + 2SO2……① 2Cu2O + Cu2S →6Cu + SO2……②。则下列说法正确的是
| A.反应②中Cu2S只发生了氧化反应 |
| B.反应①中氧化产物只有SO2 |
| C.若1molCu2S完全转化为2molCu,则转移电子数为2NA |
| D.将1molCu2S冶炼成2molCu,需要O2 1mol |
R2O8n-离子在一定条件下可把Mn2+氧化为MnO4-,若反应后R2O8n-离子变RO42-离子, 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是
| A.4 | B.3 | C.2 | D.1 |
溶液中有0.2mol XO4—,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价为
| A.0 | B.+1 | C.+3 | D.+4 |
24mL 0.05mol·L-1 Na2SO3溶液恰好与20mL 0.02mol·L-1K2Cr2O7溶液完全反应,已知Na2SO3被氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+1 | B.+3 | C.+4 | D.+6 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
| A.2.8mol·L-1 | B.3.6mol·L-1 | C.3.2mol·L-1 | D.无法判断 |
在KClO3+6HCl==KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数之比为
| A.1∶6 | B.6∶1 | C.1∶5 | D.5∶1 |
向VmLFeBr2溶液中缓慢通入amolCl2,结果溶液中有50%的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为
A.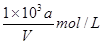 |
B.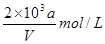 |
C.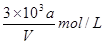 |
D.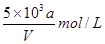 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
| A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2 |
| B.通入SO2时,SO2与I2反应,I2作还原剂 |
| C.通入SO2后溶液逐渐变成无色,体现了SO2的还原性 |
| D.滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
关于氧化还原反应10AgF+5C12+5H2O==9口+AgClO3+10HF+O2,下列说法不正确的是
| A.该反应中Cl2既是氧化剂,又是还原剂 |
| B.每生成1 mol O2,该反应转移电子的物质的量是4NA |
| C.口中的物质是AgCl |
| D.该反应消耗的水有2/5被氧化 |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
硫代硫酸钠(Na2S2O3)可作为还原剂,已知25.0mL0.0100mol/LNa2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl 离子,则S2O32-将转化成
离子,则S2O32-将转化成
| A.S2- | B.S | C.SO42- | D.SO32- |
2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中钯催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2 +H2O CO2 +Pd↓ +2HC1。下列说法正确的是
| A.题述反应条件下还原性:CO> Pd |
| B.题述反应中PdCl2被氧化 |
| C.生成22.4 L CO2时,转移的电子为2 mo1 |
| D.CO气体只有在高温下才能表现还原性 |