三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生下列反应: 3NF3+5H2O=2NO+HNO3+9HF 。则下列说法正确的是
| A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,用石灰水溶液喷淋的方法可以减少污染 |
| D.若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+则下列说法正确的是
| A.该反应中还原剂为Fe2+,O2、Fe(OH)3均为氧化产物 |
| B.充分反应后可以看到白色沉淀和气体生成 |
| C.标准状况下,每生成22.4 L O2,则有4 mol Na2O2被还原 |
| D.若有4 mol Na2O2参加反应,则反应中共转移6NA个电子 |
240 mL浓度为 0.05 mol·L-1 的Na2SO3溶液 恰好与 200mL浓度为 0.02 mol·L-1的K2X2O7溶液完全反应。已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为
| A.+2 | B.+4 | C.+5 | D.+3 |
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素既被氧化又被还原 |
| B.氧化剂与还原剂的物质的量之比为1:2 |
| C.每生成1molNa2S2O3,转移4mol电子 |
| D.相同条件下,每吸收10m3SO2就会放2.5m3CO2 |
实验室制Cl2的反应为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1mol Cl2,转移电子的物质的量为2mol |
| C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol |
| D.转移电子的物质的量为1mol时,生成在标准状况下Cl2的体积为11.2 L |
对反应14CuSO4+5FeS2+12H2O==7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
| A.该反应的氧化剂只有CuSO4 |
| B.SO42-既不是氧化产物也不是还原产物 |
C.1 mol CuSO4氧化了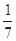 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:①SO2+2Fe3++2H2O===SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列有关说法错误的是
| A.氧化性:Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA |
| D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是60 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
将一定量硫酸、硝酸和KNO3溶液混合成100mL溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L,2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为
| A.11.2 L | B.6.72 L | C.8.96 L | D.4.48 L |
向59.2gFe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3.在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g.下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1:6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
碘在地壳中主要以NaI3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.下列说法中不正确的是
| A.用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉-KI试纸褪色的原因可能是:5Cl2+I+6H2O═2HI03+10HCl |
| C.途径Ⅱ中若生成1 molI2,则反应中转移的电子数为10NA |
| D.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
用0.1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-3mol的XO4-还原,则元素X在还原产物中的化合价是
| A.+1 | B.+2 | C.+3 | D.+4 |
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
| A.4 mo1 | B.5 mo1 | C.6 mo1 | D.7 mo1 |