“西气东输”是西部大开发的重点工程,这里的“气”指天然气,其主要成分为甲烷。
(1)工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,它们的体积比约为1∶1。已知:
2CO(g)+O2(g) 2CO2(g) ΔH=-566kJ·mol-1
2CO2(g) ΔH=-566kJ·mol-1
2H2(g)+O2(g) 2H2O(l) ΔH=-572kJ·mol-1
2H2O(l) ΔH=-572kJ·mol-1
CH4(g)+2O2(g)  CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
若不考虑水煤气中其他成分,相同状况下要获得相等的热量,所需甲烷与水煤气的体积比约为_________,它们燃烧生成的CO2的物质的量之比约为______________。
以甲烷代替水煤气作民用燃气,其优点是_________。
(2)某化工生产中用烷烃和水蒸气反应得到CO和H2为主的混合气,这种混合气可用于生产甲醇或合成氨,对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g) CO(g)+2H2(g) ΔH1=-36kJ·mol-1
CO(g)+2H2(g) ΔH1=-36kJ·mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=+216kJ·mol-1
CO(g)+3H2(g) ΔH2=+216kJ·mol-1
由反应①②推出总反应热为零的总反应方程式为____________________________;求进料气中空气(O2的体积分数为21%)与水蒸气的体积比__________。
下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,请根要求完成下列问题:
(1)有关反应的离子方程式是________________________________________________,试管中看到的现象是____________________________________。
(2)S形导管中液面A__________(填“上升”或“下降”),原因是_______________________;说明此反应是___________________(填“放热”或“吸热”)反应。
将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C
键能/ kJ•mol—1 460 360 436 431 176 347
请回答下列问题:
⑴ 比较下列两组物质的熔点高低(填>或<)
SiC______ Si; SiCl4 ______ SiO2
⑵ 图立方体中心的“●”表示硅晶体中的一个原子, 请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取: SiCl4 (g) + 2H2(g) Si(s) + 4HCl(g);该反应的反应热△H = ___________ KJ/mol
298K,101kPa时,合成氨反应的热化学方程式N2(g)+3H2(g)=2NH3(g);△H= -92.38kJ/mol。在该温度下,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么?
(12分)2008年9月25日我国“神七”成功发射,标志着我国载人航天技术迈出重要的一步。“神七”以N2H4和N2O4燃料,N2H4学名为肼又称联氨,无色油状液体,具有与氨相似的气味,毒性很大。
⑴水电离成H3O+和OH-叫做水的自偶电离。同水一样,N2H4也有微弱的自偶电离,其自偶电离的方程式为: 。
⑵氨显碱性的原因在于NH3分子中的N原子具有孤对电子,它能通过配位键结合水中的H+,使水电离出OH-,其过程可以表示为NH3+H2O NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
⑶已知硼酸[B(OH)3]为一元弱酸,其显示酸性的原理与NH3、N2H4显示碱性的原理类似,试用离子方程式表示其显示酸性的过程: 。
⑷N2H4和N2O4反应温度达2700摄氏度,产生无污染的气体。1g液态N2H4与足量的液态N2O4充分反应生成两种气态物质,可放出a KJ热量,试写出该反应的热化学方程式:
。
北京奥运会"祥云"火炬燃料是丙烷,亚特兰大奥运会火炬燃料是丙烯
。
(1)丙烷脱氢可得丙烯。
已知:
+
≡
+
;△
="156.6"
-1
=

+
=
;△
="32.4"
-1
则相同条件下,反应
=
+
的△
=
-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入和
,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,
2-移向电池的(填"正"或"负")极。
(3)碳氢化合物完全燃烧生成和
。常温常压下,空气中的
溶于水,达到平衡时,溶液的
=5.60,
(
)=1.5×10-5
-1。若忽略水的电离及
的第二级电离,则
- +
+的平衡常数
=。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液(
)
(
-)(填">"、"="或"<"),原因是(用离子方程式和必要的文字说明)。
红磷和
发生反应生成
和
。反应过程和能量关系如图所示(图中的
表示生成1
产物的数据)。

根据上图回答下列问题:
(1)和
反应生成
的热化学方程式。
(2)分解成
和
的热化学方程式,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80
,反应达到平衡时
还剩0.60
,其分解率
等于;若反应温度由
升高到
,平衡时
的分解率为
,
(填"大于"、"小于"或"等于")。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物,然后降温,再和
反应生成
。原因是。
(4)和
分两步反应生成1
的
=,
和
一步反应生成1
的
(填"大于"、"小于"或"等于")。
(5)与足量水充分反应,最终生成两种酸,其化学方程式是。
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率
(1)氯气、烧碱是电解食盐水时按照固定的比率(质量比)生成的产品。理论上
=要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和
(2)原料粗盐中常含有泥沙和等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①
、②
(盐酸)③
,这3种试剂添加的合理顺序是(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①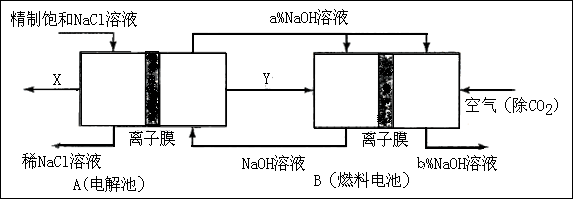
图中分别是、(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小;
 ②分别写出燃料电池
②分别写出燃料电池中正极、负极上发生的电极反应正极:; 负极:;
 ③这样设计的主要节(电)能之处在于(写出2处)、。
③这样设计的主要节(电)能之处在于(写出2处)、。
干电池应用广泛,其电解质溶液是
混合溶液。
 (1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
(1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
 (2)若
(2)若混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。

.
.
.
.
(3)的生产方法之一是以石墨为电极,电解酸化的
溶液。阴极的电极反应式是
 。若电解电路中通过2
。若电解电路中通过2电子,
的理论产量为。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应
(1)合成氨反应反应
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
 (2)
(2)
 则反应
则反应的
=
。
 (3)在25℃下,向浓度均为0.1
(3)在25℃下,向浓度均为0.1的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
 (4)在25℃下,将
(4)在25℃下,将的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂()是新型锂离子电池的首选电极材料,它的制备方法如下:
 方法一:将碳酸锂、乙酸亚铁[
方法一:将碳酸锂、乙酸亚铁[]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用表示)的结构简式如下:


 请回答下列问题:
请回答下列问题:
 (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。
 (2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、 、(填化学式)生成。
、(填化学式)生成。
 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。
 (4)写出M与足量氧化钠溶液反应的化学方程式:
(4)写出M与足量氧化钠溶液反应的化学方程式: 。
。
 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:


(1)氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为(用表示)。
 (2)负极反应式为。
(2)负极反应式为。
 (3)电极表面镀铂粉的原因为。
(3)电极表面镀铂粉的原因为。
 (4)该电池工作时,
(4)该电池工作时,和
连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下
 Ⅰ.
Ⅰ.
 Ⅱ.
Ⅱ.↑
 ①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是。
①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是。
 ②已知
②已知固体密度为0.82
。用锂吸收224
(标准状况)
,生成的
体积与被吸收的
体积比为。
 ③由②生成的
③由②生成的与
作用,放出的
用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)
| A. | 热裂解形成燃油 | B. | 露天焚烧 |
| C. | 作为有机复合建筑材料的原料 | D. | 直接填埋 |
(2)用和
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
在溶液中Cu 与
反应生成Cu2+和H2O的热化学方程式为:。
(3)控制其它条件相同,印刷电路板的金属粉末用10% 和3.0
溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度( |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是。
(4)在提纯后的溶液中加入一定量的
和
溶液,加热,生成
的离子方程式是。