2009年全国统一高考理综试卷(山东卷)化学部分
下列叙述错误的是()
| A. | 合金材料中可能含有非金属元素 |
| B. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D. | 在汽车排气管上加装"催化转化器"是为了减少有害气体的排放 |
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应
(1)合成氨反应反应 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的(填"增大""减小"或"不改变")。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的(填"增大""减小"或"不改变")。
 (2)
(2)
 则反应的=。
则反应的=。
 (3)在25℃下,向浓度均为0.1的和混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时=1.8×10-11,=2.2×10-20。
(3)在25℃下,向浓度均为0.1的和混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时=1.8×10-11,=2.2×10-20。
 (4)在25℃下,将的氨水与0.01的盐酸等体积混合,反应平衡时溶液则溶液显性(填"酸""碱"或"中");用含的代数式表示的电离常数=。
(4)在25℃下,将的氨水与0.01的盐酸等体积混合,反应平衡时溶液则溶液显性(填"酸""碱"或"中");用含的代数式表示的电离常数=。
干电池应用广泛,其电解质溶液是混合溶液。
 (1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
(1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
 (2)若混合溶液中含有杂质,会加速某电极的腐蚀,其主要原因是。欲除去,最好选用下列试剂中的(填代号)。
(2)若混合溶液中含有杂质,会加速某电极的腐蚀,其主要原因是。欲除去,最好选用下列试剂中的(填代号)。
 . . . .
. . . .
(3)的生产方法之一是以石墨为电极,电解酸化的溶液。阴极的电极反应式是 。若电解电路中通过2电子,的理论产量为。
。若电解电路中通过2电子,的理论产量为。

 金属铝的生产是以为原料,在熔融状态下进行电解:
金属铝的生产是以为原料,在熔融状态下进行电解:
请回答下列问题:
 (1)冰品石()的作用是。
(1)冰品石()的作用是。
 (2)电解生成的金属铝是在熔融液的(填"上层"或"下层")。
(2)电解生成的金属铝是在熔融液的(填"上层"或"下层")。
 (3)阴极和阳极均由材料做成;电解时所消耗的电极是(填"阳极"或"阴极")。
(3)阴极和阳极均由材料做成;电解时所消耗的电极是(填"阳极"或"阴极")。
 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成(填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成(填代号)。
 a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
和元素在化学中占有极其重要的地位。
 (1)写出的基态原子核外电子排布式。
(1)写出的基态原子核外电子排布式。
 从电负性角度分析,、和元素的非金属活泼性由强至弱的顺序为。
从电负性角度分析,、和元素的非金属活泼性由强至弱的顺序为。
 (2)的晶体结构与晶体硅的相似,其中原子的杂化方式为,微粒间存在的作用力是。
(2)的晶体结构与晶体硅的相似,其中原子的杂化方式为,微粒间存在的作用力是。
 (3)氧化物的电子总数与的相等,则为填元素符号)。是优良的耐高温材料,其晶体结构与晶体相似。的熔点比的高,其原因是。
(3)氧化物的电子总数与的相等,则为填元素符号)。是优良的耐高温材料,其晶体结构与晶体相似。的熔点比的高,其原因是。
 (4)、为同一主族的元素,和化学式相似,但结构和性质有很大不同。中与原子间形成
(4)、为同一主族的元素,和化学式相似,但结构和性质有很大不同。中与原子间形成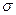 键和键,中与原子间不形成上述健。从原子半径大小的角度分析,为何、原子间能形成,而、原子间不能形成上述键。
键和键,中与原子间不形成上述健。从原子半径大小的角度分析,为何、原子间能形成,而、原子间不能形成上述键。
下列关于有机物的说法错误的是()
| A. |
可由制得,可萃取碘水中的碘 |
| B. |
石油和天然气的主要成分都是碳氢化合物 |
| C. |
乙醇、乙酸和乙酸乙酯能用饱和溶液鉴别 |
| D. |
苯不能使溶液褪色,因此苯不能发生氧化反应 |
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
孔雀石主要含,还含少量、的化合物。实验室以孔雀石为原料制备·及,步骤如下:





 请回答下列问题:
请回答下列问题:
 (1)溶液A的金属离子有+、+、+。从下列所给试剂中选择:实验步骤中试剂①为(填代号),检验溶液A中+的最佳试剂为(填代号)。
(1)溶液A的金属离子有+、+、+。从下列所给试剂中选择:实验步骤中试剂①为(填代号),检验溶液A中+的最佳试剂为(填代号)。
| A. |
|
 (2)由溶液获得·,需要经过加热蒸发、、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(2)由溶液获得·,需要经过加热蒸发、、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
 (3)制备时,应向溶液中选通入(或先加入)(填化学式)。若实验过程中有氨气逸出,应选用下列装置回收(填代号)。
(3)制备时,应向溶液中选通入(或先加入)(填化学式)。若实验过程中有氨气逸出,应选用下列装置回收(填代号)。



 (4)欲测定溶液A中+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到。用标准溶液滴定时应选用 滴定管(填"酸式"或"碱式")。
(4)欲测定溶液A中+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到。用标准溶液滴定时应选用 滴定管(填"酸式"或"碱式")。
下图中是一种具有水果香味的合成香料,是有直链有机物,与溶液作用显紫色。



请根据上述信息回答:
 (1)中含氧官能团的名称是。的反应类型为。
(1)中含氧官能团的名称是。的反应类型为。
 (2)只用一种试剂鉴别、、,该试剂是。
(2)只用一种试剂鉴别、、,该试剂是。
 (3)与互为同分异构体,在酸性条件下水解有乙酸生成,的结构简式为。
(3)与互为同分异构体,在酸性条件下水解有乙酸生成,的结构简式为。
 (4)和反应生成的化学方程式为。
(4)和反应生成的化学方程式为。
下列推断合理的是()
| A. |
明矾[
]在水中能形成
胶体,可用作净水剂

|
B. |
金刚石是自然界中硬度最大的物质,不可能与氧气发生反应

|
C. |
浓
有强氧化性,不能与
发生剧烈反应

|
D. | 将 通入品红溶液,溶液褪色后加热恢复原色;将 通入溴水,溴水褪色后加热也能恢复原色 |
下列关于氯的说法正确的是
| A. | Cl 2具有很强的氧化性,在化学反应中只能作氧化剂 |
| B. | 若 17 35Cl、 17 37Cl为不同的核素,有不同的化学性质 |
| C. | 实验室制备Cl 2,可用排饱和食盐水集气法收集 |
| D. | 1.12LCl 2含有1.7N A个质子(N A表示阿伏伽德罗常数) |
 是制备硫酸的重要反应。下列叙述正确的是()
是制备硫酸的重要反应。下列叙述正确的是()
| A. |
催化剂
不改变该反应的逆反应速率

|
B. |
增大反应体系的压强,反应速率一定增大

|
C. |
该反应是放热反应,降低温度将缩短反应达到平衡的时间

|
D. | 在 、 时刻, 的浓度分别是 , ,则时间间隔 内, 生成的平均速率为 |
 变化的曲线如右图所示。据图判断正确的是
变化的曲线如右图所示。据图判断正确的是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号