A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。

(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试用化学方程式表示该物质与二氧化碳气体的反应 。将C长期露置于空气中,最后将变成物质D,D的化学式为 。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为 。
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:

①收集A的方法是 ,验证A是否已经收集满的方法是 (任写一种)。
②写出实验室制取A的化学方程式 。
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为 L。
④试写出C与水反应的化学方程式 ,反应可得到酸X,X是 电解质(填“强”或“弱”)。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式 。实验完毕后,试管中收集到的气体的主要成分为 (写化学式)。

某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为 (填化学式下同)。反应的化学方程式为 。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为 。反应的化学方程式为 。
(3)若A为紫红色金属,D为有色气体。则A为 。反应的离子方程式为 。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为 。反应的离子方程式为 。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为 。反应的化学方程式为 。
A、B、C、D均为中学化学中的常见物质,请根据题中信息回答问题。
(1)已知它们存在如下反应转化关系:A +B→C +D(未配平,反应条件略去)。
①该转化关系中所涉及的反应为置换反应。若A是金属单质,D是非金属单质,且A 原子的质子数是D原子的2倍,则反应的方程式是 。
②该转化关系中所涉及的反应为非置换反应。若A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是 。
(2)已知它们存在如下反应转化关系:A +B→C +D+H2O(未配平,反应条件略去)。
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,当A的摩尔质量小于B时,物质B的名称为 ,鉴别C、D两种气体不能选用的试剂是 。
a.Ba(OH)2溶液
b.酸性KMnO4溶液
c.紫色石蕊试液
d.H2O2与BaCl2混合液
e.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3∶4时,则C与D物质的量之比为 。
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。请回答下列问题: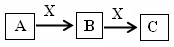
(1)若X是强氧化性单质,则A不可能是__________(填序号)
A.C B.N2 C.S D.Mg E.Al
(2)若A能使湿润的红色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程式为_________________。若B是一种常见的温室气体,则B转化为C的化学方程式 。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B的化学式为____________。保存C溶液常加入少量X,其目的是________________________________。
(4)若A、B、C均为含有铝元素的化合物,若X为NaOH溶液,则A与X生成B的离子方程式_____________________________;若X为稀硫酸,则A与X生成B的离子方程式________________。
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)
请回答下列问题:
(1)A的电子式为 。
(2)H的化学式为 。
(3)写出反应①的离子方程式 。
(4)写出反应②的化学方程式 。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟生成E,A是强碱,D的焰色为紫色 (部分反应物和生成物及水已略去)。
请回答下列问题
(1)写出工业制备B的化学方程式_____________________________________;
(2)写出常温下,A与丁反应的离子方程式________________________________;
(3)下图装置为用排空气法收集气体的实验装置
Ⅰ.当从M端通入气体时,可收集的气体有 ;
Ⅱ.当从N端通入气体时,可收集的气体有 ; (填数字编号)
①气体乙 ②气体丙 ③气体丁 ④气体B ⑤气体C
(4)E中所含阳离子的检验方法为(包括实验步骤、现象及结论) ;
(5)A中所含阳离子的检验方法为(包括实验步骤、现象及结论) 。
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。
(1)H的化学式为 。
(2)F的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
甲、乙、丙、丁四种物质(可以是溶液)中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。按要求回答下列问题:
。按要求回答下列问题:
(1)若甲为碳,则乙为________(填化学式,下同),丙为_________。
(2)若甲为氯气,则丁为_______,丙为_________。
(3)若甲为二氧化硫,丁为氢氧化钠溶液,则丙→乙的离子方程式为_____________。
(4)若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙→丙的离子方程式为_____________。
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的 =2.5×
=2.5× 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol· 的BaCl2溶液中,其
的BaCl2溶液中,其 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol· 。
。
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(3)若D是一种常见的温室气体,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,固体C受热分解可得固体B,该反应的化学方程式是 。
(4)若D为氯碱工业的主要产品,B具有两性,则B转化为C的离子方程式为 。
(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则元素D在周期表中的位
置是 ,B分子的结构式为 。
A、B、C、D、E、F、X存在如图所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。X可能是强酸,也可能是强碱。
(1)A的化学式是___________________。
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为_____________________________。
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物。
①过量的B跟Cl2反应的化学方程式为______________________。
②工业生产中B→D的化学方程式为_______________________。
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为 。
由以上某些元素组成的化合物A、B、C、D有如下转化关系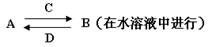
其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式 ;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是 。
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出)。
(1)若A是常见金属单质,与B的水溶液反应生成C和D。D、F是气体单质,D在F中燃烧时发出苍白色火焰。则F所对应的元素在周期表位置是 ;反应②(在水溶液中进行)的离子方程式为 。
(2)若A、D为短周期元素组成的固体单质,A为金属,D为非金属。且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
① ;④ 。
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是 ,分子E的结构式是 。
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
(1)A的电子式为 ;所含化学键类型为 、 。(各1分)
(2)溴元素在周期表的位置 丁元素的阴离子结构示意图为 。(各2分)
(3)反应(I)的化学方程式为 。
(4)反应(II)的离子方程式为 。
(5)含1mol C的溶液中缓慢通入15.68 L的CO2(标况),所得溶液中溶质的物质的量之比为 (式量大的比式量小的)
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
回答下列问题:
(1)起始滤液的pH_____7(填“大于”“小于”或“等于”),其原因是______________________________;(用离子方程式表示)
(2)试剂Ⅰ的化学式为___________,①中发生反应的离子方程式为_______________;
(3)试剂Ⅱ的化学式为____________,②中加入试剂Ⅱ的目的是__________________;
(4)试剂Ⅲ的名称是_____________,③中发生反应的离子方程式为________________;