如图中的所有物质均由短周期元素组成。其中甲、乙、丙、丁为单质,常温下甲、乙为无色气体,丁为黄绿色气体。丙是常见金属,广泛用于航天、航空工业。工业上从海水中提取G后再通过电解G制取丙,同时得到副产物丁。A、E的分子中均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体,E在常温下是无色无味的溶液。框图中各物质转化所涉及的条件均已省略。回答下列问题:
(1)反应①~⑤中属于氧化还原反应的是_________(填序号)。
(2)画出丙的原子结构示意图_________,写出A的电子式_________,写出A、B的等电子体(原子数和电子数均相等的粒子) _________、_________ (用化学式表示)。
(3)C的水溶液显酸性,用离子方程式解释_______________________________
_______________________________________________________________________________。
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:
(1)请写出反应①的化学方程式_____________________________________。
(2)检验D溶液中Y离子的方法是__________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,将G的饱和溶液滴入沸水中,煮沸可得到红褐色胶体。请回答下列问题:
(1)A的电子式为 ,乙的组成元素在周期表中的位置是
(2)反应①~⑤中,属于非氧化还原反应的是 (填序号);C中含有的化学键有 (填序号:a离子键; b极性键 ;c 非极性键)
(3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 。
(4)F溶液中阳离子的检验方法为
(5)在F溶液中加入与F等物质的量的A恰好使F转化为E,写出该反应的离子方程式 。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 (只写一种)。
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为 。
(3)若D的氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为 。
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出)。

(1)若A、D、E是短周期的非金属单质,且 A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为________;F的分子构型为________;反应①的化学方程式为__________________。
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式_ _________________;足量的A与B溶液充分反应后,生成物C中金属阳离子的检验方法为__________________;若以惰性电极电解B的水溶液,当阴极增重9.6g时,阳极生成气体在标准状况下的体积为________,写出电解B的水溶液的离子方程式__________________。
Ⅰ.有关物质存在如图所示的转化关系(部分产物已省略)。通常B为黑色粉末,C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
请回答下列问题:
(1)反应①的化学方程式为________________________________;
(2)反应②的离子方程式为________________________________ ;
(3)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。浓度为0.01mo1/L的D溶液与a mo1/L的Pb(NO3)2溶液等体积混合,则生成沉淀所需a的最小值为____________;
(4)电解F的溶液可以实现电能转化为化学能,请写出惰性电极电解足量的F溶液的离子方程式________________________________。
Ⅱ.辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为______mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____________。
原子序数由小到大排列的四种短周期元素X、Y、 Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M2Z2的电子式_________,写出M2Z2与水反应的离子方程式__________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为
__________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是__________
(填化学式).写出该气体B与氯水反应的离子方程式__________________________________________。(6)由X、Y、 Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为_______________________________________。
②试写出C与M2Z2按物质的量比1:2在溶液中反应的化学方程式____________________________。
A、B、C、D是中学化学中常见的单质, D为地壳中含量最多的金属;甲、乙、丙为化合物,其中甲为有磁性的黑色晶体,乙在常温常压下为无色液体。各物质的转化关系如下: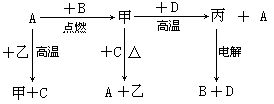
(1)组成D的元素在周期表中的位置是 。
(2)若用一种反应类型概括上述转化中所涉及到的全部反应,该反应类型是 。
(3)在上述电解反应中,阳极的电极反应式是 。
(4)甲和D反应的化学方程式是 。
(5)D的某种盐常用于净水,用离子方程式表示其净水原理 。
已知A、B、C、D、E、X存在下图示转化关系(部分生成物和反应条件略).
(1)若E为非金属氧化物,则A与水反应的化学方程式 。
①当X是碱性溶液,C分子中有22个电子时,表示X溶液呈碱性的离子方程式为 ,用结构式表示C分子: 。
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为 。
(2)若E为常见单质气体,D为白色胶状沉淀,A的化学式可能是 ,B中含有的化学键类型为 ,C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应生成C和一种可燃性气体单质,则该可逆反应的化学方程式为 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的化学平衡常数K=1,则D的转化率为 。
下图是由一些常见元素组成的单质及其化合物之间的转化关系图。常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去)。请回答下列问题:
从反应②的实验现象可以得出物质C具有的某些物理性质有(写两点): 。
(2)J暴露在空气中的现象是 。
(3)①--⑦的反应中属于非氧化还原反应的有 。
(4)反应①的化学方程式为 。
(5)将115g甲酸(HCOOH)完全燃烧后的产物通过足量的固体A中,固体A将增重 g。
现有X、Y、Z三种非金属元素,A、B、C三种金属元素,有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,火焰呈苍白色。产物XZ的水溶液可使石蕊试液变红。
(3)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体。
(4)Z的单质溶于X2Y中所得溶液具有漂白性。
(5)A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈黄色溶液。
(6)B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解。
(7)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色固体M。
请完成下列问题:
①写出下列物质的化学式:XZ ,X2Y ,M 。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是 (填化学式)
③A的单质与Z的单质反应的化学方程式:
④BZ3与过量的NaOH溶液反应的离子方程式: 。
⑤X单质与Z单质的混合气体经点燃充分反应后,冷却至室温,再通入足量的NaOH溶液中,气体被完全吸收,求原混合气体中X单质与Z单质的体积比可能为 。
下图所示的物质转化关系中,各物质均为短周期主族元素组成的单质或化合物。已知:A、C、D、F、K均为单质;C、E、F、G、K常温下是气体,且K为工业上制造漂白粉的原料之一;J为白色沉淀且既能溶于B的水溶液,又能溶于E的水溶液;B、G可以使湿润的红色石蕊试纸变蓝;反应④是工业制化肥的重要反应之一。(图中部分反应条件及物质未列出)
请回答下列问题:
(1)B的电子式为 。
(2)H的化学式为 。
(3)写出反应④的化学方程式 。
(4)写出反应⑤的离子方程式 。
下图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体, E为淡黄色的固体。它们之间有如下转化关系:
(1)写出A的化学式 ;C的结构式 ;
(2)A溶液与过量F溶液反应的离子方程式
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:
(1)写出下列物质的化学式:气体B是_____________,H是_______________,
(2)写出A与NaOH溶液反应的离子方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:_____________________________________________;
(4)写出反应“F→G”的离子方程式:____________________________________________;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
其反应的原理是(化学方程式)_________________________________________________.
(6)检验溶液J中的金属阳离子,用______________________试剂(填化学式),其现象是
_________________________________.
置换反应的通式可表示为:
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,写出离子方程式: 。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为 。
(3)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(5)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式 。
(6)若化合物B为黑色磁性晶体,,气体单质乙能在空气中燃烧,写出该反应的化学方程式 。