[上海]2014届上海市六校高三12月联考化学试卷
下列说法正确的是
| A.“雾霾”与“风雨雷电”一样属于一种自然现象 |
| B.塑化剂是一种应用很广的化工塑料软化剂,可大量添加到婴幼儿玩具中 |
| C.利用潮汐能发电能达到节能减排的目的 |
| D.PM 2.5的产生与人类活动无关 |
硫化氢分子中,形成共价键的原子轨道是
| A.硫原子的2p轨道和氢原子的1s轨道 |
| B.硫原子的2p轨道和氢原子的2p轨道 |
| C.硫原子的3p轨道和氢原子的1s轨道 |
| D.硫原子的2p轨道和氢原子的3p轨道 |
用酸性KMnO4溶液不能达到预期目的的是
| A.区别苯和甲苯 |
| B.检验硫酸铁溶液中是否有硫酸亚铁 |
| C.检验CH2=CHCHO中含碳碳双键 |
| D.区别SO2和CO2 |
下列推断正确的是
| A.Na2O和Na2O2组成元素相同,与CO2反应产物也相同 |
| B.SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C.NO和NO2的密度均比空气大,都可用向上排空气法收集 |
| D.C3H8和CH3CH2OH相对分子质量相近,分子间作用力相近,二者沸点也相近 |
水在氧化还原反应中可以是氧化剂、还原剂、同时既是氧化剂又是还原剂、既不是氧化剂又不是还原剂等。下列反应与Cl2+SO2+2H2O→H2SO4+2HCl比较,水的作用不相同的是
①2Na2O2+2H2O→4NaOH+O2↑
②4Fe(OH)2+O2+2H2O→4Fe(OH)3
③2F2+2H2O→4HF+O2
④2Al+2NaOH+2H2O→2NaAlO2+3H2↑
| A.①③ | B.③④ | C.①④ | D.②④ |
向溶液X中持续通入气体Y,会产生“浑浊→澄清”现象的是
| A.X:氯化铝溶液 Y:氨气 | B.X:硝酸钡溶液 Y:二氧化硫 |
| C.X:漂粉精溶液 Y:二氧化碳 | D.X:偏铝酸钠溶液 Y:二氧化氮 |
下图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是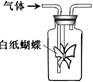
| |
A |
B |
C |
D |
| 喷洒液 |
酚酞 |
黄色甲基橙 |
紫色石蕊 |
酸化的KI-淀粉 |
| 通入的气体 |
NH3 |
Cl2 |
SO2 |
O2 |
| 预测的颜色变化 |
变为红色 |
先橙后褪色 |
先红后褪色 |
变为蓝色 |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
| A.若M(甲)>M(乙),则气体体积:甲<乙 |
| B.若M(甲)<M(乙),则气体的压强:甲>乙 |
| C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙 |
| D.若M(甲)<M(乙),则的分子数:甲<乙 |
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH |
2 |
4 |
6 |
6.5 |
8 |
13.5 |
14 |
| 腐蚀快慢 |
较快 |
慢 |
较快 |
||||
| 主要产物 |
Fe2+ |
Fe3O4 |
Fe2O3 |
FeO2- |
下列说法不正确的是
A.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e→2H2O
D.在pH<4溶液中,碳钢主要发生析氢腐蚀
25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L NaHSO4 | B.0.1 mol/L Na2CO3溶液 |
| C.pH = 4盐酸溶液 | D.pH =11氨水 |
NA表示阿伏加德罗常数的值,常温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是
| A.反应前气体的总体积为0.448L |
| B.生成物中含有0.01NA个分子 |
| C.装置中氢元素的总质量为0.04g |
| D.生成物完全溶于水后所得溶液含有0.01 NA个NH4+ |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是
| A.贝诺酯分子可与6molH2完全反应 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D.乙酰水杨酸和对乙酰氨基酚均可与NaHCO3溶液反应 |
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| A.非金属性:T<X <R |
| B.气态氢化物稳定性:R <T<Q |
| C.R与Q的电子数相差16 |
| D.X与Q最高价氧化物的水化物的质子数相差18 |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2 、H2SO4 |
K2SO4 、MnSO4 ...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- ...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子。则该硫酸盐的物质的量浓度为(NA表示阿佛加德罗常数的值)
| A.1mol·L-1 | B.2.5 mol·L-1 | C.5 mol·L-1 | D.2 mol·L-1 |
Al63Cu24Fe13是自然界中的一种天然准晶体,将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(盐酸)<n(稀硝酸)<n(烧碱) | B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(烧碱)<n(稀硝酸)<n(盐酸) | D.n(稀硝酸)<n(烧碱)<n(盐酸) |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |
在5.6 g Fe粉中加入过量的稀硫酸溶液,待反应完全后,再加入1mol·L-1 KNO3溶液25mL,恰好反应完全。该反应的方程式为:
FeSO4 +KNO3 +H2SO4→K2SO4 +Fe2(SO4)3+NxOy + H2O(未配平),则对该反应的下列说法正确的是
| A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
| B.反应中氧化产物是N2O |
| C.反应过程中转移的电子数为8mol电子 |
| D.氧化产物和还原产物的物质的量之比为4∶1 |
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
N2(g)+3H2(g) 2NH3(g) +92.4 kJ。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) +92.4 kJ。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
将Cu、Cu2O和 CuO均匀混合物分成两等份,其中一份用足量的CO还原,测得反应后固体质量减少6.4g,另一份中加入150mL某浓度的硝酸,固体恰好完全溶解,且同时收集到标准状况下NOX气体6.72L,则所用硝酸的物质的量浓度可能为
| A.8.0mol·L-1 | B.9.0mol·L-1 | C.10.0mol·L-1 | D.11.0mol·L-1 |
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为 。
由以上某些元素组成的化合物A、B、C、D有如下转化关系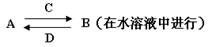
其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式 ;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是 。
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是_________________________________________,
装置A中的足量的试剂是 。
(2)连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:____________________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是_______________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:____________________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是__________________,_________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式___________________________________________________________。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③洗涤;④干燥。
(4)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
(5)判断滴定终点的现象 。原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
二茂铁(如图)是一种有机过渡金属化合物,不溶于水,易溶于苯、乙醚等有机溶剂。由烃A可制备二茂铁。A分子是一种没有侧链的环状结构,其一氯取代物有三种,1molA最多可与2molBr2加成,其与Br2的1:1加成只得两种产物。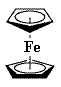
(1)A的结构简式为 。
(2)下列说法正确的是 。
| A.烃A具有烯烃的性质 | B.烃A具有苯的性质 |
| C.烃A分子中所有的碳原子可能在同一平面 | D.烃A不可能发生取代反应 |
(3)写出A的1,4-加成聚合反应的化学方程式
二茂铁氯乙酰是有机合成的中间体,下面是其合成路线: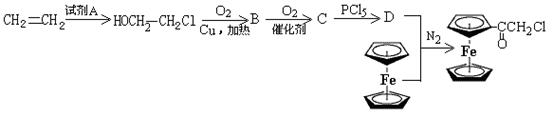
(4)写出有关物质的化学式:试剂A ,C (结构简式)。
(5)B→C的反应类型是 ,最终合成二茂铁乙酰氯的反应类型是 。
(6)写出C与足量NaOH溶液反应的化学方程式: 。
化合物A(C6H6O)是一种重要的有机化工原料,A 的有关转化反应如下(部分反应条件略去):
已知:
(R表示烃基,R′和R″表示烃基或氢)
(1)写出A 的结构简式: 。
(2)G是常用指示剂酚酞。写出G的分子式 。
(3)某化合物是E的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物结构简式: (任写一种)。
(4)F和D互为同分异构体。写出反应E→F的化学方程式: 。
(5)结合相关信息,写出以A和HCHO为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号