[山东]2013-2014学年山东省文登市高一上学期期末统考化学试卷
下列说法正确的是
| A.氨气是非电解质,氨水是电解质 |
| B.氢氧化铁胶体可以发生丁达尔现象 |
| C.摩尔和物质的量均是联系宏观和微观数量的物理量 |
| D.二氧化硅既可和酸又可和碱反应,所以二氧化硅是两性氧化物 |
下列说法正确的是(NA表示阿伏加德罗常数)
| A.1mol钠和足量水反应可生成11.2L氢气 |
| B.常温常压下,32g氧气中含有2NA个氧分子 |
| C.1mol/LK2SO4溶液中,含有2mol钾离子 |
| D.标准状况下,22.4LHCl溶于水后溶液中含有NA个氢离子 |
下列说法错误的是
| A.氮的氧化物是汽车尾气中的主要污染物之一 |
| B.氮的氧化物既可形成酸雨,又是光化学污染的主要成分 |
| C.化石燃料的燃烧是造成空气中二氧化硫含量增多的主要因素 |
| D.酸雨在空气中静置一段时间后,雨水的酸性会慢慢减弱 |
下列说法正确的是
| A.二氧化硫具有漂白性,所以可以使溴水褪色 |
| B.硫在少量氧气中燃烧生成二氧化硫,在过量氧气中燃烧生成三氧化硫 |
| C.雷雨天氮元素可以进行下列转化:N2→NO→NO2→HNO3 |
| D.氮气的化学性质非常稳定,不支持任何物质的燃烧 |
下列关于氧化还原反应的说法,正确的是
| A.氧化还原反应的特征是电子的转移 |
| B.氧化剂在反应中被还原,生成氧化产物 |
| C.同一反应中,氧化剂得电子的总数一定等于还原剂失电子的总数 |
| D.任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂可以为同种物质 |
下列叙述正确是的
| A.人工固氮的过程一定涉及到氧化还原反应 |
| B.1mol氯气在反应中一定得到2mol电子 |
| C.1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子 |
| D.发生化学反应时,失去电子越多的金属原子,还原能力越强 |
下列推断正确的是
| A.钠的活泼性比铜的强,所以钠可和硫酸铜溶液反应生成铜 |
| B.氢氧化铝是两性氢氧化物,所以氢氧化铝可溶解在氨水中 |
| C.浓硝酸易分解,所以要用棕色瓶盛放,且放在阴凉处保存 |
| D.金刚石是自然界中硬度最大的物质,所以金刚石不能与氧气反应 |
下列叙述I和叙述II均正确并且有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
二氧化硅有导电性 |
二氧化硅可用于制备光导纤维 |
| B |
次氯酸有强氧化性 |
次氯酸可以使有色布条褪色 |
| C |
Fe3+具有氧化性 |
可以用KSCN溶液检验的Fe 3+存在 |
| D |
Na2O、Na2O2组成元素相同 |
与二氧化碳反应产物也相同 |
下列在溶液中可以大量共存的一组离子是
| A.K+、SO42-、Cu2+、NO3- | B.Fe3+、Na+、I-、HCO3- |
| C.Mg2+、H+、SiO32-、SO42- | D.K+、NH4+、OH-、SO42- |
下列有关的离子方程式书写正确的是
| A.氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42- = BaSO4↓ |
| B.浓盐酸与铁屑反应:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| C.SO2通入溴水中:SO2+ Br2+2H2O =SO42-+2Br-+ 4H+ |
| D.钠放于水中:Na + 2H2O = Na++2OH-+H2↑ |
对实验Ⅰ~Ⅳ的叙述正确的是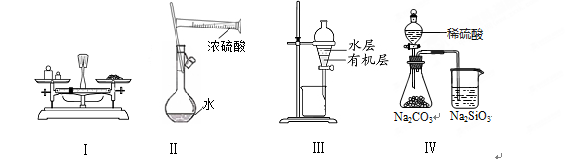
| A.实验Ⅰ:用托盘天平称量一定质量的氯化钠固体 |
| B.实验Ⅱ:配制一定物质的量浓度的硫酸 |
| C.实验Ⅲ:用苯萃取溴水中的溴后进行分液 |
| D.实验Ⅳ:比较硫酸、碳酸和硅酸酸性强弱 |
下列除杂质或鉴别方法可行的是
| A.用过量氨水除去Al3+溶液中的少量Fe3+ |
| B.将混合气体通过灼热的铜网除去N2中的少量O2 |
| C.向某溶液中加HCl酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
| D.向澄清石灰水中通入少量气体产生沉淀,过量时沉淀溶解,说明该气体一定是CO2 |
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
下列关于铜、铝、铁的说法,正确的是
| A.三种金属常温下均不溶于足量的浓硝酸中 |
| B.三种金属久置于潮湿的空气中均能生成氧化物而生锈 |
| C.三种金属均能与硫反应,分别生成Cu2S、Al2S3、FeS |
| D.三种金属的还原性:Al>Fe>Cu;离子的氧化性:Cu2+>Fe3+>Al3+ |
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
下列关于第①步的说法,错误的是
| A.Al起始反应的离子方程式为2Al + 6H+ = 2Al3+ + 3H2↑ |
| B.滤液I中一定含有Cu2+、Al3+;一定含有Fe2+和Fe3+中的一种或两种 |
| C.滤渣I的主要成分是Au与Pt,由此可以回收贵重的金属 |
| D.加入稀硫酸可以提高硝酸的利用率,使硝酸根离子完全反应 |
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
下列关于第②步和第③步的说法,正确的是
| A.加入H2O2的主要作用是将溶液中的Fe2+氧化为Fe3+ |
| B.CuSO4·5H2O和Al2(SO4)3·18H2O均属于混合物 |
| C.实验室中过滤时可直接将滤液倒入有滤纸的漏斗中 |
| D.高锰酸钾溶液也可以氧化Fe2+,所以第②步中可以用酸性高锰酸钾溶液代替H2O2 |
已知滤渣2的主要成分是Fe(OH)3和Al(OH)3,由滤渣2制取Al2(SO4)3·18H2O,该探究小组设计了如下实验方案:
下列关于此方案的说法,错误的是
| A.加入NaOH溶液后过滤,滤渣为Fe(OH)3 |
| B.也可以先加硫酸,再加NaOH溶液后蒸发、冷却、结晶、过滤 |
| C.加硫酸后,溶液中的盐除含有硫酸铝外,还有硫酸钠 |
| D.如果滤渣2中含1molAl(OH)3,则至少需要1molNaOH才能使Al(OH)3完全溶解 |
将5.6g铁溶于足量稀盐酸中,再加入足量的氢氧化钠溶液,充分反应,过滤;在空气中加热所得滤渣,灼烧到质量不再变化,此时固体的质量为
| A.7.2g | B.8.0g | C.9.0g | D.10.7g |
将1.68g铁粉加入到30.0mL的1.00 mol·L-1MO2+溶液中,恰好完全反应,向溶液中滴加KSCN溶液,溶液颜色没有变化,则还原产物可能是
| A.M | B.M+ | C.M2+ | D.M3+ |
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘、镁等。按要求回答下列问题:
(1)可以证明溴比碘的氧化性强的离子反应方程式为____________________________。
(2)从海带灰中提取的碘单质,往往含有一定的杂质,通常利用加热的方法除去杂质,这个过程中主要利用碘性质中的___________,也可以通过萃取分液的方法提取碘,实验室中分液时,分液漏斗中的上层液体应从分液漏斗的_______(填“上”或“下”)口倒出。
(3)点燃的镁条可以在二氧化碳气体中继续燃烧,该反应的化学方程式为__________。
甲、乙、丙、丁四种物质(可以是溶液)中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。按要求回答下列问题:
。按要求回答下列问题:
(1)若甲为碳,则乙为________(填化学式,下同),丙为_________。
(2)若甲为氯气,则丁为_______,丙为_________。
(3)若甲为二氧化硫,丁为氢氧化钠溶液,则丙→乙的离子方程式为_____________。
(4)若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙→丙的离子方程式为_____________。
识图绘图是重要的技能。按要求回答下列问题:
(1)向碳酸钠溶液中,逐滴加入盐酸,生成气体的物质的量与加入盐酸体积如甲图所示,则OA段发生反应的离子方程式为________,AB段发生反应的离子方程式为________。
(2)在乙图中补充向澄清石灰水中通入CO2,生成沉淀质量与CO2体积的关系图。
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
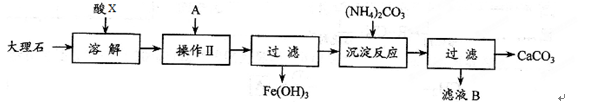
(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2) 检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
(3) 写出加入碳酸铵所发生反应的离子方程式: 。
写出加入碳酸铵所发生反应的离子方程式: 。
(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置)。仅用此装置和表中提供的部分物质完成相关实验。
| 序号 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| 甲 |
浓硫酸 |
Na2SO3 |
① |
② |
| 乙 |
浓硝酸 |
Cu |
③ |
NaOH |
| 丙 |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
按要求回答下列问题:
(1)表格中①②③三种物质分别是__________、__________、________(填化学式)。
(2)实验乙中生成气体③的离子反应方程式为________________________;某同学认为将浓硝酸改为稀硝酸,即可以利用本套装置制取NO气体,该同学的设计________(填“正确”或“不正确”)。
(3)已知实验丙中生成氯气的化学方程式为4HCl(浓)+MnO2  MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
____ MnO4-+ ____ H+ + ____ Cl- ____ Mn2+ + ____ Cl2↑+ ____ _________
____ Mn2+ + ____ Cl2↑+ ____ _________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号