将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生白烟,A是强碱,D的焰色反应呈紫色(部分反应物和生成物及溶剂水已略去)。
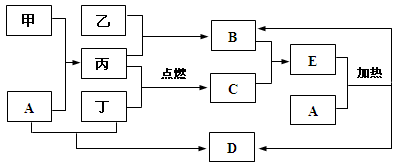
请回答下列问题:
(1)D的化学式为 。
(2)C的电子式为 。
(3)写出A溶液和甲反应的离子方程式: 。
(4)写出工业上制备B的化学方程式: 。
下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色。反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨。

请回答下列问题:
(1)B的化学式为 ,J的化学式为 。
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 。
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 。
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 。
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 。
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去)。请回答下列问题: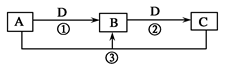
(1)若A是一种可用于自来水消毒的黄绿色气体,D是生活中常用的金属单质,则C的化学式为__________;写出A与C反应的离子方程式________________________。
(2)若A是一种常见的强碱,C常用于糕点发酵,则反应①的离子方程式是________________。
(3)若A是一种碱性气体,常用作制冷剂,B、D是空气中的主要成分,则C的化学式为_________。
(4)若A是一种无色、有臭鸡蛋气味的气体,C是导致酸雨的主要气体,则反应③的方程式为________。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。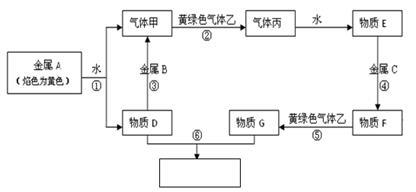
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A、______B、______C、________乙__________
(2)写出下列反应化学方程式:
反应①___________________________________
反应③___________________________________
(3)写出下列反应离子方程式:
反应④___________________________________
反应⑥___________________________________
A、B、C、D四种化合物,其中A、C、D均含有钠元素,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味的气体,又可制得C。若B的溶液滴加到硫酸亚铁溶液中,现象为出现白色沉淀→灰绿色沉淀→红褐色沉淀E。试判断:
(1)A: ___________ E: _____________(写化学式)
(2)①C加热分解的化学方程式_____________________________;
②物质C在水溶液中的电离方程式:__________________________;
③由白色沉淀最终变为红褐色沉淀E的化学方程式________________________________。
有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C、E、G是中学化学中的常见单质,A为黑色粉末,G为黄绿色气体,E在G 中燃烧时发出苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀。

请回答下列问题:
(1)G的化学式为 ,F的化学式为 。
(2)D、B、H混和生成J和I的离子方程式: 。
(3)常温下G与F的溶液反应的离子方程式:
(4)J转变为I的化学方程式:
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。

请回答:
(1)写出A与B反应的化学方程式: 。
(2)写出第④步反应的离子方程式为 。
(3)写出向F溶液中通入B时发生反应的离子方程式 。
(4)写出Cu与D溶液反应的离子方程式 。
(5)用离子方程式表示D溶液中滴加KSCN溶液显红色的原因 。
(6)向F溶液中滴入NaOH溶液过程中发生的氧化还原反应化学方程式为 。
下图所示各物质是由1~18号部分元素组成的单质或化合物,图中部分反应条件及产物未列出。已知:A、B、H的焰色反应呈黄色;A、C、D、F均为单质,物质G是使湿润的红色石蕊试纸变蓝的气体:J为白色沉淀,既能溶于B,又能溶于E。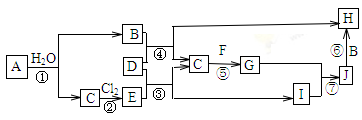
回答下列问题:
(1)写出物质G的一种用途_________________。
(2)①~⑦中属于化合反应的是______________________。
(3)按要求写出下列反应的表达式
物质I的电离方程式为_______________,反应①的离子方程式为_______________________,
反应⑥的化学方程式为______________________。
(4)向I的水溶液中滴加B溶液至过量,观察到的现象为______________________。
A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。

请回答下列问题:
(1)A物质的名称为________________;
(2)C与D在高温下的反应在冶金工业上称为 反应,C与D反应的化学方程式: 。
(3)写出G→J的化学方程式:___ ;
写出J→D的化学方程式: ;
(4)A→H的离子方程式为_____________________________;
(5)用离子方程式表示I物质能用于净水的原理___________ _。
下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种生活中常见金属单质之一,D是淡黄色固体单质。
请回答下列问题:
(1)A、G的化学式分别为A________,G________;
(2)用物理方法洗去试管内壁的D,应选择的试剂是_______________;
(3)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是________(填字母);
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(4)写出反应E+H2O2→F的离子反应方程式:______________________________;
(5)写出B→C的离子反应方程式:_______________________________________;
(6)若足量A与少量F在加热条件下反应,得到E和另一种气体,其体积比为1:1,则参加反应的A与F的物质的量之比为_______________。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与 E同周期;E元素原子的最外层电子数是其次外层电子数的 3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是_______________。
(2)由A、B、C三种元素形成的离子化合物的化学式为_________________。
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)_______________。
(4)F含有的化学键类型是___________和_____________,其水溶液呈酸性,请用相关的离子方程式解释其原因___________。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为______。
A、B、C、D、E 五种物质存在以下转化关系,已知A 为金属单质,在以下各步反应中E 是白色沉淀。
(1)试确定各物质的化学式:
A ________________B __________C__________ D________________ E____________
(2)写出以下反应的离子方程式:
A →C _________________________________
B →E _________________________________