(14分)有关元素A、B、C、D的信息如下:
| 元 素 |
有关信息 |
| A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B |
地壳中含量最高的元素,A与B可形成一种质量比为 7:12的化合物(丙) |
| C |
单质曾用于焊接钢轨 |
| D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)用C单质来焊接钢轨的化学方程式是 。
(2)有关C与D元素,下列说法正确的是 (填序号)。
A.C或D的高价盐均可用做净水剂
B.用C或D单质做成的槽车,都可用来运输甲的稀溶液
C.C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
D.C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是 。
(4)已知:2AB2(g) A2B4(g) △H<O。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通人容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g) △H<O。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通人容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
①a、b、c、d四个点中,化学反应处于平衡状态的是 点。
②25min时,增加了 (填物质的化学式) mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是 (填字母)。
某溶液中可能含有OH-、CO32—、AlO2—、SiO32—、SO42—、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量浓度的盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示[已知:AlO2—+HCO3—+H2O=Al(OH)3↓+CO32—]。回答下列问题:
(1)原混合溶液中一定含有的离子是________;
(2)AB段反应的离子方程式是__________________________;
(3)AB段和盐酸反应的离子与BC段和盐酸反应的物质的物质的量之比为______________。
中学化学常见物质A在一定条件下发生如下反应:A+B→E+F+H2O(未配平)
(1)若A为小苏打,F为气体。该反应的离子方程式为 。
(2)若A为紫红色金属单质,气体F是由两种位于同一主族的短周期元素组成。则反应的化学方程式为_____________________。
(3)若A是磁铁矿的主要成分,B是盐酸。写出反应的化学方程式为 。
(4)若A为黄氯色气体单质,F的碱性溶液吸收废气中SO2的离子方程式为 。
由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程:
回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,写出一个可能产生无色气体2的反应的离子方程式:
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3成分是 ,已知固体混合物丁的的质量为5.6g,在标准状况下无色气体3的体积为14.56L,求无色气体3各成分的物质的量: 。(写出具体的计算过程)
下图中的每1方格表示一种有关的反应物或生成物。其中A、C为无色气体。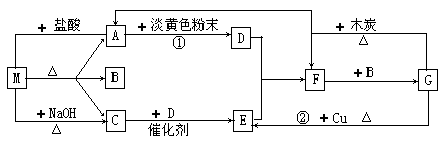
完成下列问题:
(1)物质M可以是 ,F是 。
(2)反应①除生成D外,生成的另一种物质的水溶液显碱性,用离子方程式解释溶液显碱性的原因: 。
(3)检验M中阳离子的方法: 。
(4)G到E的离子反应方程式: ,每生成标况下1.12L的E,转移电子 mol。
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 |
X |
Y |
Z |
| 分子中含有的原子个数 |
/ |
4 |
/ |
| 摩尔质量/g·mol-l |
32 |
34 |
/ |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为 ,则X的化学式为 .
,则X的化学式为 .
(2)Y的化学性质描述正确的是 。
a.不稳定性 b.弱碱性 c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH= 。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)= mol·L-1。
(4)将一定量的Z气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
①O点溶液中所含溶质的化学式为 。
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是 。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。(用离子方程式表示)
某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)生成甲的化学反应方程式为
(2)甲与水反应可得H2,其化学方程式是 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:______________________________________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________;D中所含化学键的类型为________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的式量相等,请用离子方程式表示F的水溶液呈酸性的原因:_______________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
B转化为C的化学方程式为_______________________________________。
下图中,B、D、E、F、G是氧化物,F和K都是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,其水溶液与D均具有漂白性。O是白色沉淀,在空气中很容易转化为N,且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其工业制备过程包括反应⑤和⑥(图中部分反应物和生成物没有列出)。请按要求回答:
(1)写出L的化学式: 。
(2)写出:反应③的离子方程式 ;
反应④的化学方程式 ;
反应④的现象是 。
(3)反应②在工业生产上的用途是 。
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则反应①的化学方程式为 。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
请回答下列问题: (1)B单质的电子式是 ,C和E两种元素相比较,非金属性可以验证该结论的是(填写编号) ;
(1)B单质的电子式是 ,C和E两种元素相比较,非金属性可以验证该结论的是(填写编号) ;
A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为 ;
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A2和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: ;
②B2A4是一种可燃性液体,B2A4——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液,该电池放电时的负极反应式为: 。
③右图是一个电解装置示意图,假设使用B2A4——空气燃料电池作为本装置中的电源,通电前两极铜片的质量相等,通电一段时间后两极铜片的质量相差12.8g,则通过电路的电子的物质的量为 。
氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。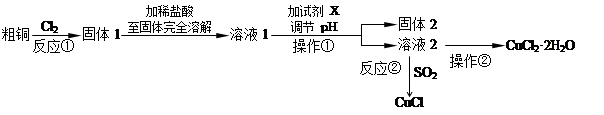
按要求回答下列问题:
(1)操作①的名称是______________,检验溶液2中是否含有杂质离子的试剂是 。操作②需在氯化氢气流中经过加热浓缩、 、过滤、洗涤、干燥。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
a.NaOH b.NH3·H2O c.CuO d.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。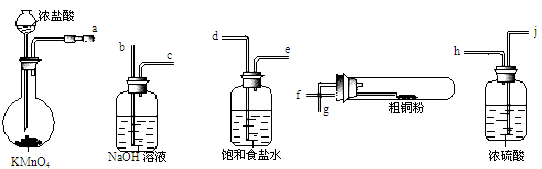
①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验开始前要进行一步重要操作,其操作名称是 。
②反应时,盛粗铜粉的试管中的现象是 。
③反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为 。
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
一些氢氧化物沉淀的pH如下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) |
4 |
2.3 |
10.4 |
| 完全沉淀pH(离子浓度<10-5 mol/L) |
5.2 |
4.1 |
12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现红色。
(1)写出下列物质的化学式:
A: D:
E: N: 。(每空1分)
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: 。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2) 、
、 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:_____________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。在该溶液中溶质中含有的化学键类型是 。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。