在一定条件下,氯气可以与氯化铵发生如下反应:xCl2+yNH4Cl==yNClx+(x+y)HCl,当消耗6.72L(标准状况)的氯气时,生成0.1mol氮的氯化物,则此氮的氯化物的化学式为
| A.NCl2 | B.NCl3、 | C.NCl4 | D.NCl5 |
如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。
则液体A和气体B的组合不可能是下列的
A.氢氧化 钠溶液.二氧化碳 钠溶液.二氧化碳 |
B.水.氨气 |
| C.氢氧化钠溶液.一氧化氮 | D.水.二氧化氮 |
将磁性氧化铁放入稀HNO3中发生反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移 |
| C.稀HNO3 在反应中只作氧化剂 |
| D.磁性氧化铁中的铁元素全部被氧化 |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
将3.84g铜粉加入到80mL lmol·L-1的稀硝酸溶液中,充分反应后,再向溶液中加入下列物质,充分搅拌后,铜粉仍然不能完全溶解的是
| A.80mL l mol·L-1的稀硝酸溶液 | B.80mL 0.5mol·L-1的稀盐酸 |
| C.80mL lmnl·L-1的FeCI3溶液 | D.80mL 0.5mol·L-l的稀硫酸溶液 |
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知: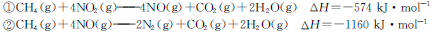
下列说法正确的是
A.反应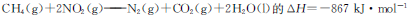 |
| B.若用CH4还原0.2mol NO2至N2,在上述条件下放出的热量为173.4 kJ |
| C.若用CH4还原l mol NOx为N2的过程中,若x=1.6,则生成0.4mol CO2 |
| D.若用标准状况下2.24LCH4还原NOx至N2,整个过程中转移电子0.4 mol |
同温同压下,在4支相问体积的试管巾分別充有等体积的2种气体,它们是(1 ) NO和 O2 ( 2 ) NO2和 O2 ( 3 ) NO和 NO2 ( 4 )HCl和N2。现将4支试管均倒置于水槽中,充分反应后剩余气体的体积分别是 ,则下列关系正确的是
,则下列关系正确的是
A. |
B. |
C. |
D. |
向lL0.8mol/L硫酸溶液中加入20.2gKN03和19.2g铜粉,充分反应后产生的气体是 ____,在标准状况下的体积为______,( )
| A.氢气2.24L | B.一氧化氮4.48L |
| C.氢气 4.48L | D.一氧化氮2.24L |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4,NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为: 。则生成
。则生成
的盐溶液中NaNO3的物质的量为
| A.0.4 mol | B.0.2 mol | C.0.6 mol | D.0.8 mol |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为
| A.1∶6 | B.16∶25 | C.2∶11 | D.1∶7 |
已知25%的氨水的密度为0.91 g/cm3,5%的氨水的密度为0.98 g/cm3.若将上述两溶液等体积混合,所得氨水的质量分数是
| A.等于于15% | B.大于15% |
| C.小于15% | D.无法确定 |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共0.8mol,这些气体恰好能被500mL2mol/L NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为
| A.0.3 mol | B.0.4 mol | C.0.5 mol | D.0.6 mol |
若以w1和w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2a=b,则下列推断正确的是
| A.2w1=w2 | B.2w2=w1 | C.w2>2w1 | D.w1<w2<2w1 |
体积为1L的干燥容器中充入氨气,测得容器中气体对氢气的相对密度为9.7。用此气体进行喷泉实验,当喷泉停止后,进入容器中液体的体积约是( )
| A.0.2L | B.0.25L | C.0.75L | D.0.8L |