[山西]2011-2012学年山西省高三上学期第二次阶段性测试化学试卷
化学是一门中心学科,与社会发展的需要有密切的关系。下列说法正确的是
| A.无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| B.绿色化学的核心是在化学合成中将原子充分利用,转化为新的原子 |
| C.为防止月饼等富脂食品氧化变质,常在包装袋内放人生石灰 |
| D.城市停车场安装催化光解设施,可将汽车尾气中的CO和NOx转化为无毒气体 |
太平洋岛国瑙鲁盛产一种高品位的磷矿石——鸟粪石,其化学式为MgNH4PO4,下列关于该物质的叙述中不正确的是
| A.鸟粪石既属于镁盐又属于磷酸盐 |
| B.鸟粪石既能与强酸反应,又能与强碱反应 |
| C.鸟粪石中既含有离子键又含有共价键 |
D.鸟粪石中两种阳离子的电子式分别为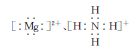 |
下列有关实验的叙述正确的是
| A.为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体 |
| B.可用激光笔鉴别KI溶液和淀粉溶液 |
| C.可用pH试纸测定新制的氯水的pH |
| D.可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验 |
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有
| A.3种 | B.4种 | C.5种 | D.6种 |
下列推断正确的是
| A.等质量的NaHCO3和Na2CO3固体中,分别加入等体积的0.1 mol·L-1盐酸,NaHCO3产生的气体多 |
| B.加入铝粉能产生H2的溶液中,一定不存在NO—3 |
| C.SO2通人品红溶液,溶液褪色后加热恢复原色;SO2通入溴水,溴水褪色后加热也能恢复原色 |
| D.电子工业中,用三氯化铁溶液腐蚀铜箔印刷线路板,该过程发生了电化学腐蚀 |
设NA为阿伏加德罗常数的数值,下列说法不正确的是
| A.标准状况下,11.2 L NH3中含有N—H键的数目为1.5NA |
| B.常温下100 mL0.1 mol·L-1 NH4 HCO3溶液中,含有的氧原子数为0.03 NA |
| C.标准状况下,将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| D.由NaHSO4和KHSO3组成的120 g混合物中含有的阴阳离子总数为2NA |
某无色溶液中只可能含有Na+、Ba2+、Mg2+、Cl—、Br-、SO2-3、SO2-4,对该溶液进行下列实验, 实验操作和现象如下表: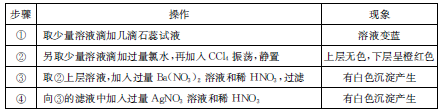
下列结论正确的是
| A.可能含有Cl-、Mg2+、SO2-4 | B.肯定没有Ba2+、Cl-、Br- |
| C.不能确定的离子有Mg2+、SO2-3-、SO2-4 | D.肯定含有Na+、Br-、SO2-3 |
下列离子方程式书写正确的是
A.将等体积等物质的量液度的NaHCO3溶液与Ba(OH)2溶液混合: |
B.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中: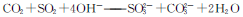 |
C.向次氯酸钙溶液中通入过量二氧化碳: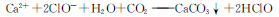 |
D.用Na2CO3溶液吸收Br2蒸气: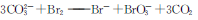 |
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知: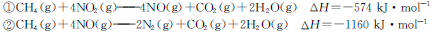
下列说法正确的是
A.反应 |
| B.若用CH4还原0.2mol NO2至N2,在上述条件下放出的热量为173.4 kJ |
| C.若用CH4还原l mol NOx为N2的过程中,若x=1.6,则生成0.4mol CO2 |
| D.若用标准状况下2.24LCH4还原NOx至N2,整个过程中转移电子0.4 mol |
下图①表示向含MgCl2、AlCl3、NH4Cl三种物质的混合溶液中逐滴加入NaOH溶液时,沉淀的物质的量与NaOH溶液的体积关系;图②表示某反应过程中的能量关系。下列各表述与示意图不一致的是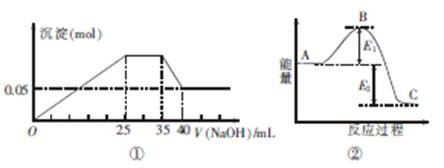
| A.图①中三种离子的物质的量之比n(Mg2+):n(Al3+):n(NH+4)=1:1:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中若使用催化剂,B点会降低 |
| D.图②中若由物质C反应生成物质A,则反应的活化能为E1+E2 |
某矿石由前20号元素中的四种组成,其化学式为WYZX4。X、Y、Z、W分布在三个周期,且 原子序数依次增大,Y、Z处于相邻主族,Y、W为金届元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。则下列判断正确的是
| A.Y、Z的氧化物都有两性 |
| B.气态氢化物的稳定性:Z>X |
| C.原子半径:W>Y>Z>X |
| D.最高价氧化物对应水化物的碱性:W<Y |
某氧化还原反应中包含下列物质:Na3AsO4、H2O2、Na2SO4、As2S3、H2O和NaOH。已知H2O2是唯一的氧化剂,水是生成物。下列有关说法正确的是
| A.NaOH是生成物 |
| B.反应中As2S与H2O2的物质的量之比为1: 14 |
| C.配平后化学计量数最大的物质是H2O2 |
| D.生成l mol H2O时转移1.2 mol电子 |
向含有1 mol HNO3和1mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是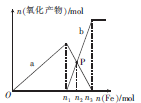
| A.a表示Fe3+的关系曲线 |
| B.n1=0.75 |
| C.P点时,n(Fe2+)="0.5625" mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4 g |
“走迷宫”是深受大众欢迎的益智游戏,某同学以“盐酸”的身份走人化学迷宫,迷宫里有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。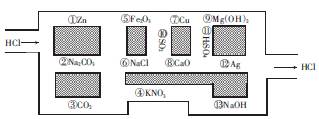
(1)“盐酸”经过的物质序号依次为 。
(2)在(1)中所写物质中,属于电解质的是 (填序号,下同),属于非电解质的是 。
(3)请根据不同的分类标准将图中能与盐酸反应的物质分为两类,结果填在下表中:
新型陶瓷氮化铝可用Al2O3高温还原法制备: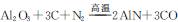 ,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
已知:AIN溶于强碱时会生成NH3。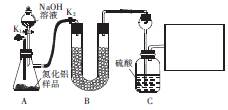
(1)从原料角度分析,AIN中的杂质可能是 ,装置A中产生气体的化学方程式为 。
(2)装置B中的试剂是____;装置C中长颈漏斗的作用是 。
在上图右边的方框中,画出所缺装置图,并注明装置中的试剂。
(3)充分反应后,需打开K1,通入一段时间N2,其目的是 。
(4)若样品的质量为mg,实验前后装置C增重ng,则样品中AIN昀纯度为 。
某同学在学习元素周期表后,将第二至第六周期的主族和零族元素排列成“八角星”元素周期表(如图),图中每个“·”代表一种元素,每个“八角星”代表一个周期,元素X核外 有5个电子层。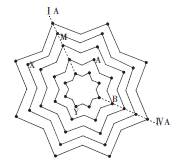
(1)M的元素符号是 ,元素Y的原子结构示意图为 。
(2)在上图中用“O”圈出磷元素的位置。
(3)实验室制取少量单质B时,可用单质A与B的氧化物在高温下反应,有关反应的化学方程式为 。
(4)单质A分别与某一主族元素(位于第二至第五周期,均用R表示)单质反应生成AR2的能量变化如图所示(反应物和产物均为298 K时的稳定状态)。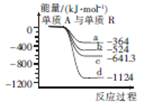
①元素R位于元素周期表中第 族。
②写出生成曲线d代表的物质的热化学方程式: 。
X、Y和W为原子序数依次递增的短周期主族元素,X和Y同主族,且能形成气态化合物YX2。试回答下列问题:
(1)W的原子序数为 。
(2)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成、再向该试管中加入 (填字母),可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.硝酸钠 D.氯化钙溶液
(3)某小组设计如图所示的装置图(图中夹持和加热装置略去),研究W2的性质。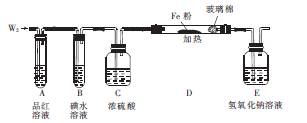
①装置A、D中观察到的现象分别为 、 。
②若装置B中装有5.0 mL l.0×10-3 mol·L-1碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(4)若由元素Y和X组成-2价酸根离子M,M中Y和X的质量比为4:3,已知1mol W2与含1mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则W2与含M的溶液反应的离子方程式为 。
A~H有如图所示的转化关系,其中A是盐,B、C、D、E、F在常温常压下均是气态物质,反应④、⑤均在溶液中进行,转化中反应条件略去。
试回答下列问题:
(1)物质A的化学式为 ,电解时阴极反应式为 .
(2)反应③的化学方程式为 。
(3)反应⑤的离子方程式为 。
(4)镁与铝能形成多种合金,为了确定某合金样品的成分,小明同学设计如图所示的实验步 骤,确定合金组成。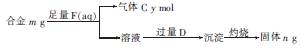
①能确定合金组成的数据组有 (填字母)。
a.m、n b.m、y c.n、y
②若合金中Mg的物质的量分数为x,金属总物质的量为7 mol,试在图中作出y随x变化的曲线。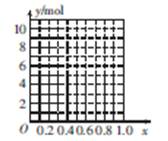
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下: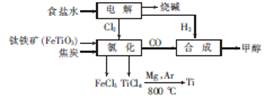
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式: 。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是 。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为 。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛 g(精确到0.1,下同),甲醇厂CO的转化率为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号