向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
下列事实,可以证明氨水是弱碱的是
| A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 |
| B.铵盐受热易分解 |
| C.0.1mol/L的氨水可以使酚酞试液变红 |
| D.0.1mol/L的NH4Cl溶液的pH约为5 |
用以下三种途径来制取等质量的硝酸铜:①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述不正确的是
| A.三种途径所消耗的铜的质量相等 |
| B.所消耗的硝酸的物质的量是①>②>③ |
| C.途径③的制备方法是最符合“绿色化学”理念的 |
| D.途径①中被氧化的铜与被还原的硝酸的物质的量比是3:2 |
某无色混合气体中可能含有Cl2、O2、HCl、SO2、NO2、NO、NH3中的两种或多种。将此无色混合气体通过品红溶液后,品红溶液褪色;把剩余气体排入空气中,气体很快变为红棕色,该无色混合气体遇浓盐酸未看到明显现象。下列关于原混合气体成分的判断正确的是
| A.一定有SO2、NH3和NO | B.一定有NO和HCl |
| C.可能有Cl2和O2 | D.一定没有Cl2、NO2、NH3和O2 |
完成下列实验所选择的装置或仪器不正确的是
| |
A |
B |
C |
D |
| 实验 |
分离水和酒精 |
用铵盐和碱制取NH3 |
用排空气法收集NO2 |
用自来水制取蒸馏水 |
| 装置 或 仪器 |
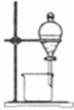 |
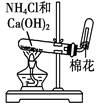 |
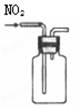 |
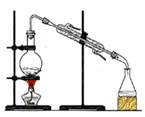 |
下列说法正确的是
| A.铵盐不稳定,受热分解都产生氨气 |
| B.N2是空气中的主要成分之一,雷雨时可直接转化为NO2 |
| C.由于浓硫酸有强氧化性,因此不能用铁罐贮存浓硫酸 |
| D.Cl2与石灰乳反应可以制得含氯漂白剂 |
化学与生活、社会密切相关。下列说法正确的是
| A.正常雨水的pH值为7.0,酸雨的pH值小于7.0 |
| B.亚硝酸盐常做食品防腐剂,可以大量添加于食物中 |
| C.自然界中的固氮作用对植物的生长有害无益 |
| D.大量燃烧化石燃料是造成雾霾天气的重要原因之一 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
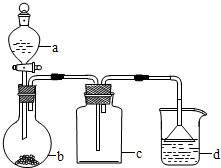
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
饱和食盐水 |
MnO2 |
Cl2 |
NaOH溶液 |
化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 |
现象或事实 |
解释或对应的方程式 |
| A |
用热的纯碱溶液洗去油污 |
CO32-+2H2O H2CO3+2OH- H2CO3+2OH-溶液呈碱性 |
| B |
酸雨样品在空气中放置pH减小 |
亚硫酸被氧化为硫酸2SO32-+O2=2SO42- |
| C |
“84”消毒液具有漂白性 |
2ClO-+CO2+H2O=2HClO+CO32- |
| D |
用加热法除去NaOH固体中混有的NH4Cl固体 |
NH4Cl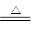 NH3↑+HCl↑ NH3↑+HCl↑ |
下列气体遇空气变红棕色的是
| A.SO2 | B.Cl2 | C.CO2 | D.NO |
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
下列对于硝酸的认识,不正确的是( )
| A.浓硝酸在见光或受热时会发生分解 | B.金属与硝酸反应不产生氢气 |
| C.可用铁和铝制品盛装浓硝酸 | D.铜与硝酸的反应属于置换反应 |
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.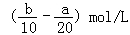 |
B.(2b﹣a)mol/L |
C.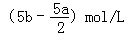 |
D.(10b﹣5a)mol/L |
1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
| A.0.336L | B.0.224L | C.0.168L | D.0.504L |