3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O下列有关说法中不正确的是( )
| A.HNO3在反应中既表现氧化性也表现出酸性 |
| B.每生成22.4L NO(标准状况)有3mol电子转移 |
| C.HNO3作氧化剂,铜作还原剂,3mol Cu还原8mol的HNO3 |
| D.HNO3作氧化剂,铜作还原剂,3mol Cu还原2mol的HNO3 |
下列关于硝酸的认识中,正确的是( )
| A.浓硝酸和稀硝酸都具有氧化性 |
| B.浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 |
| C.因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 |
| D.硝酸与金属反应时,只表现出氧化性 |
科学的假设和猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定没有意义的是
| A.探究SO2和Na2O2反应可能有Na2SO4生成 |
| B.探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O |
| C.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用 |
| D.探究NO和N2O可能化合生成NO2 |
实验室中保存下列试剂的方法,不正确的是
| A.保存氢氧化钠溶液,常用带橡胶塞的玻璃瓶 |
| B.保存浓硝酸,常用带玻璃塞的棕色试剂瓶 |
| C.保存金属铝时,常在试剂瓶中加入煤油进行封存 |
| D.保存氢氟酸时,常用塑料瓶而不用玻璃瓶 |
下列关于氨气的说法正确的是
| A.氨气既能用浓硫酸干燥也能用无水CaCl2干燥 |
| B.NH3是电解质,所以氨水能导电 |
| C.用水吸收NH3用如图装置可防止倒吸 |
| D.NH3可以使干燥的红色石蕊试纸变蓝 |
某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)="2.5" mol•L-1.取200mL该混合酸,则能溶解铜的最大质量为( )
| A.12.8g | B.19.2g | C.32.0g | D.38.4g |
某固体混合物可能含有Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2、NaCl中的一种或几种,现对该混合物做如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积):下列说法不正确的是( )
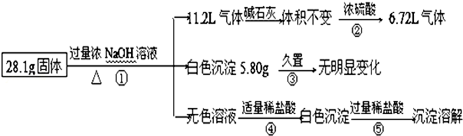
| A.混合物中一定不存在FeCl2和NaCl |
| B.反应④的离子方程式为:AlO2﹣+H++H2O=Al(OH)3↓ |
| C.混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 |
| D.白色沉淀5.80g是Mg(OH)2 |
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pd/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指

| A.汽车尾气催化转化机理 | B.钢铁生锈机理 |
| C.合成氨工业催化氧化机理 | D.氢氧燃烧电池电极反应机理 |
高氯酸铵(NH4ClO4)和铝粉常用作火箭推进剂的固体燃料。高温时,NH4ClO4的分解反应是:2NH4ClO4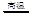 N2↑+4H2O↑+Cl2↑+2O2↑,下列有关NH4ClO4的分解及保存方法说法不合理的是
N2↑+4H2O↑+Cl2↑+2O2↑,下列有关NH4ClO4的分解及保存方法说法不合理的是
| A.点燃铝粉可以引发NH4ClO4分解 |
| B.NH4ClO4迅速分解时可能会引发爆炸 |
| C.NH4ClO4应低温通风保存,远离火种、热源 |
| D.0.5 mol NH4ClO4分解时产生的气体体积是44.8 L |
根据下列有关实验得出的结论一定正确的是
| 选项 |
方法 |
结论 |
| A |
实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 |
可以加快制备氢气的反应速率 |
| B |
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 |
氧化性:H2O2>Fe3+ |
| C |
相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 |
反应速率: 粉状大理石>块状大理石 |
| D |
吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 |
则该反应的△S<0 |
下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是

| 选项 |
实验现象 |
解释 |
| A |
红色石蕊试纸变蓝 |
NH3极易溶于水 |
| B |
浓硫酸附近无白烟 |
NH3与浓硫酸不发生反应 |
| C |
氯化铝溶液变浑浊 |
NH3与AlCl3溶液反应:Al3++3OH–→Al(OH)3↓ |
| D |
浓盐酸附近有白烟 |
NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |