(1)已知:Fe(s)+1/2O2(g)═2FeO(s) △H1=-272.0kJ•mol-1 ①;
2Al(s)+3/2O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1 ②
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”“减小”或“不变”)。
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃< K1200℃,若降低体系温度,混合气体的平均相对分子质量将会 (填“增大”“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃< K1200℃,若降低体系温度,混合气体的平均相对分子质量将会 (填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol/LHA溶液与0.1 mol/lNaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH一浓度与0.1 mol/lNaOH溶液中由水电离出的OH一浓度之比为 。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
试推断(NH4)2 CO3溶液的pH (填“<”“>”或“=”)7;
相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 (填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题。
(1)常温下,某Na2CO3溶液的pH=12,则水电离的c(H+)= 。若向该Na2CO3溶液中加入等体积、等物质的量浓度的盐酸,溶液中离子浓度大小排序为 。此时溶液中水的电离程度 (填“大于”等于或小于”) Na2CO3溶液中水的电离程度。
(2)合成氨反应N2(g)+3H2 (g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
则平衡 (填“向正反应方向”“向逆反应方向”或“不”)移动。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2 (g)。下表为反应在T1温度下的部分实验数据:则500 s内N2O5的分解速率V(N2O5)= ;降温至T2,反应进行1 000 s时测得c(NO2)=4.98 mol/L。则反应2N2O5(g)
4NO2(g)+O2 (g)。下表为反应在T1温度下的部分实验数据:则500 s内N2O5的分解速率V(N2O5)= ;降温至T2,反应进行1 000 s时测得c(NO2)=4.98 mol/L。则反应2N2O5(g) 4NO2(g)+O2 (g)的△H (填“>=或<”)0。
4NO2(g)+O2 (g)的△H (填“>=或<”)0。
| T/s |
0 |
500 |
1000 |
| c(N2O5)/mol•L-1 |
5.00 |
3.50 |
2.42 |
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2=2N2+6H2O。你认为电解质溶液应显 (填“酸性”“中性”或“碱性”),写出正极的电极反应方程式: 。
(8分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_______ __ ___。
(2)若溶液M由10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合而得,
则溶液M的pH_ __7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_ _ __。
(3)若溶液M有下列三种情况:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,
则三种情况的溶液中H2A分子浓度最大的为______;pH由大到小的顺序为______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于、等于、小于”或“均有可能”)。
泡沫灭火器的工作原理就是我们学习的盐类水解,它是彻底的双水解,
(1)灭火器有两个桶构成,一个是外面的钢桶,用来盛装 (硫酸铝、碳酸氢钠填药品的化学式)一个是里面看不到的塑料桶,用来盛装 。(同上)
(2)用离子方程式表示塑料桶盛放该试剂的原因 。
(3)用离子方程式表示其工作原理 。
(4)用碳酸氢钠而不用碳酸钠做灭火器的药品其原因是 。
(5)碳酸氢钠溶液中质子守恒的表达式是 。
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) ,△H=?,反应情况记录如下表:
pC(g) ,△H=?,反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= 。
(5) 判断第9 min时是否达平衡,说明理由 。
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为: 。
草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)本滴定达到终点的标志是: ;
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 ,(填“偏高”、“偏低”、或“不变”)。
Ⅱ、草酸氢钠溶液显酸性,常温下,向10 mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是: 。
| A.V(NaOH)=0时,c(H+)= 1×10-2 mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)= 1×10-7 mol/L |
| D.V(NaOH)>10mL时, c(Na+)> c(C2O42-)> c(HC2O4-) |
铜合金及铜的氯化物在生产生活中有着广泛的应用。请回答下列问题:
(1)向硫酸铜、氯化钠混合溶液中滴加亚硫酸钠溶液生成CuCl沉淀,实验测得溶液的pH与亚硫酸钠溶液体积的关系曲线如图所示。
①用离子方程式解释亚硫酸钠溶液呈碱性的原因: 。
②用离子方程式解释图像中V<a时溶液酸性增强的原因: 。
当V>a时,随着亚硫酸钠溶液的体积增大,溶液pH增大的原因是 。
(2)已知:Ksp(AgCl)=8×10-10,Ksp(CuCl)=1.2×10-6。向CuCl 浊液中滴加硝酸银溶液,发生反应CuCl(s)+Ag+(aq) AgCl(s)+Cu+(aq),该反应平衡常数K= 。
AgCl(s)+Cu+(aq),该反应平衡常数K= 。
(3)硫酸铜溶液中含少量硫酸铁,加入氢氧化铜,过滤,除去三价铁离子,写出加入氢氧化铜时发生反应的离子方程式: 。
(4)测定CuCl和CuCl2混合物中CuCl含量的原理为用氯化铁溶液溶解样品,以邻菲罗啉作指示剂,用Ce(SO4)2溶液滴定至终点,滴定反应为Ce4++Fe3+=Fe2++Ce3+。氯化铁与氯化亚铜反应的离子方程式为 。
I常温下,浓度均为0.1molL-1六种溶液的PH如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
Na2SO4 |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
7.0 |
请回答下列问题:
(1)上述盐溶液中的阴离子,结合质子的能力最强的是 。
(2)将CO2气体通入 饱和的碳酸钠溶液中,可以观察到的现象为 (结合离子方程式加以描述)。
(3)要增大氯水中的HClO的浓度,可向氯水中加入少量的碳酸钠溶液,用离子方程式解释原因 。
II、已知:25ºC时,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na3PO4溶液中,c(Na+)/c(PO43—) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 。
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
 |
 |
 |
  |
 |
   |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_________________________。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 ;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。
已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:
。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为___________________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=_____________________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” ,下同)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO |
HSCN |
H2CO3 |
| K=3.2×10-8 |
K=0.13 |
Kl=4.2×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是 (用A.B.C回答)
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。
其PH由大到小的顺序是: (填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
a.c(H+) b.c(OH-)
c. d.
d.
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
氢氧化钠溶液的浓度 (mol·L-1) |
滴定完成时,氢氧化钠溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
| 1 |
0.10 |
24.12 |
20.00 |
| 2 |
0.10 |
23. 88 |
20.00 |
| 3 |
0.10 |
24.00 |
20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
(12分) .
(1)稀释0.1 mol·L-1氨水时,随着水量的增加而减小的是 (填写序号)。
①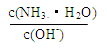 ②
②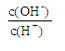 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需的时间B>A
②开始反应时的速率A>B
③参加反应的锌粉物质的量A=B
④反应过程中的平均速率B>A
⑤A溶液里有锌粉剩余
⑥B溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的_________曲线(填写序号) 。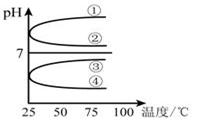
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______________ 。
(5)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。